la Nature des spectres de masse
un spectre de masse sera généralement présenté sous la forme d’un graphique à barres verticales, dans lequel chaque barre représente un ion ayant un rapport masse / charge spécifique (m / z) et la longueur de la barre indique l’abondance relative de l’ion. L’ion le plus intense se voit attribuer une abondance de 100, et il est appelé le pic de base. La plupart des ions formés dans un spectromètre de masse ont une seule charge, de sorte que la valeur m/z est équivalente à la masse elle-même., Les spectromètres de masse modernes distinguent facilement (résolvent) les ions différant par une seule unité de masse atomique, et fournissent ainsi des valeurs complètement précises pour la masse moléculaire d’un composé. L’ion de masse la plus élevée dans un spectre est normalement considéré comme l’ion moléculaire, et les ions de masse inférieure sont des fragments de l’ion moléculaire, en supposant que l’échantillon est un seul composé pur.
la masse atomique est donnée en termes d’Unité de masse atomique unifiée (symbole: μ) ou de dalton (symbole: Da). Ces dernières années, il y a eu un changement progressif vers l’utilisation du dalton de préférence à l’Unité de masse atomique unifiée., Le dalton est classé comme une « unité non-SI dont les valeurs en unités SI doivent être obtenues expérimentalement ». Il est défini comme un douzième de la masse de repos d’un atome non lié de carbone-12 dans son état fondamental nucléaire et électronique, et a une valeur de 1,660538782(83)X10-27 kg.
Le diagramme suivant montre les spectres de masse de trois composés gazeux simples, le dioxyde de carbone, le propane et le cyclopropane. Les molécules de ces composés sont de taille similaire, CO2 et C3H8 ont tous deux une masse nominale de 44 Da, et C3H6 a une masse de 42 Da., L’ion moléculaire est l’ion le plus fort dans les spectres du CO2 et du C3H6, et il est modérément fort dans le propane. La résolution massique unitaire est facilement apparente dans ces spectres (on notera la séparation des ions ayant m/z=39, 40, 41 et 42 dans le spectre cyclopropane). Même si ces composés sont de taille très similaire, il est simple de les identifier à partir de leurs spectres de masse individuels. En cliquant tour à tour sur chaque spectre, une analyse de fragmentation partielle et l’affectation des pics seront affichées., Même avec des composés simples comme ceux-ci, il convient de noter qu’il est rarement possible d’expliquer l’origine de tous les ions de fragments dans un spectre. En outre, la structure de la plupart des ions de fragments est rarement connue avec certitude.
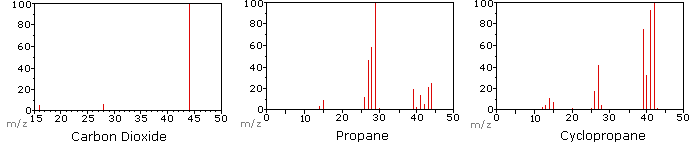
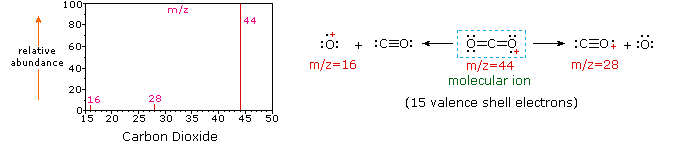

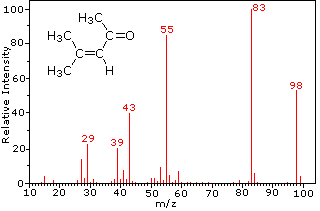
Depuis une molécule de dioxyde de carbone est composé que de trois atomes, son spectre de masse est très simple. L’ion moléculaire est également le pic de base, et les seuls ions de fragment sont CO (m/z=28) et O (m/z=16)., L’ion moléculaire du propane a également m / z=44, mais ce n’est pas l’ion le plus abondant dans le spectre. Clivage d’une liaison carbone-carbone donne de méthyle et d’éthyle fragments, dont l’un est un carbocation et de l’autre un radical. Les deux distributions sont observées, mais le plus grand cation éthylique (m/z=29) est le plus abondant, peut-être parce que sa taille offre une plus grande dispersion de charge. Un clivage de liaison similaire dans le cyclopropane ne donne pas deux fragments, de sorte que l’ion moléculaire est plus fort que dans le propane, et est en fait responsable du pic de base., La perte d’un atome d’hydrogène, avant ou après l’ouverture du cycle, produit le cation allyle stable (m/z=41). Le troisième ion le plus fort du spectre a m/z=39 (C3H3). Sa structure est incertaine, mais deux possibilités sont présentées dans le diagramme. Le faible ion M / z=39 dans le propane et l’absence d’ion M/z=29 dans le cyclopropane sont particulièrement significatifs pour distinguer ces hydrocarbures.
la plupart des composés organiques stables ont un nombre pair d’électrons totaux, reflétant le fait que les électrons occupent des orbitales atomiques et moléculaires par paires., Lorsqu’un seul électron est retiré d’une molécule pour donner un ion, le nombre total d’électrons devient un nombre impair, et nous nous référons à de tels ions comme des cations radicaux. L’ion moléculaire dans un spectre de masse est toujours un cation radical, mais les ions de fragment peuvent être des cations paires d’électrons ou des cations radicaux impairs d’électrons, selon le fragment neutre perdu. Les fragmentations les plus simples et les plus courantes sont les clivages de liaison produisant un radical neutre (nombre impair d’électrons) et un cation ayant un nombre pair d’électrons., Une fragmentation moins commune, dans laquelle un fragment neutre à électrons pairs est perdu, produit un ion fragment de cation radical à électrons impairs. Les ions de fragments eux-mêmes peuvent se fragmenter davantage. En règle générale, les ions d’électrons impairs peuvent se fragmenter en ions d’électrons impairs ou pairs, mais les ions d’électrons pairs ne se fragmentent qu’en autres ions d’électrons pairs. Les masses moléculaires et des ions fragments reflètent également les électrons, en fonction du nombre d’atomes d’azote dans l’espèce.,
|
Ions ayant pas d’azote |
impair d’électrons des ions |
même électrons des ions |
|---|---|---|
|
les Ions ayant un |
impair d’électrons des ions |
même électrons des ions |
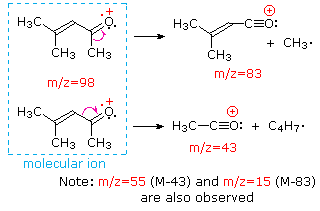
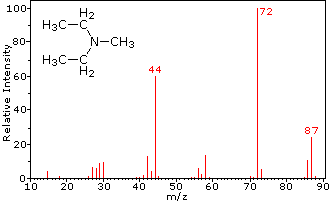
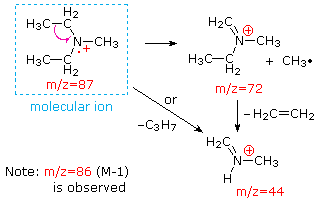
Cette distinction est joliment illustré par le prédécesseur de deux exemples., La cétone insaturée, le 4-méthyl-3-pentène-2-one, à gauche n’a pas d’azote, de sorte que la masse de l’ion moléculaire (m/z = 98) est un nombre pair. La plupart des ions fragments ont des masses impaires et sont donc des cations d’électrons pairs. La diéthylméthylamine, quant à elle, a un azote et sa masse moléculaire (m/z = 87) est un nombre impair. La majorité des ions fragments ont des masses paires (les ions à m/z = 30, 42, 56 & 58 ne sont pas marqués) et sont des cations azotés à électrons pairs., Les faibles ions d’électrons pairs à m/z=15 et 29 sont dus à des cations méthyle et éthyle (pas d’atomes d’azote). Les fragmentations menant aux ions de fragments principaux seront affichées en cliquant sur le spectre approprié. Des clics répétés feront défiler l’affichage.,
|
|
|
|
|
4-methyl-3-pentene-2-one |
N,N-diethylmethylamine |
|---|
When non-bonded electron pairs are present in a molecule (e.g., sur N ou O), les voies de fragmentation peuvent parfois être expliquées en supposant que l’électron manquant est partiellement localisé sur cet atome. Quelques mécanismes de ce type sont présentés ci-dessus. Le clivage de liaison génère un radical et un cation, et les deux fragments partagent souvent ces rôles, bien qu’inégalement.