A Natureza dos Espectros de Massa
Uma massa espectro normalmente apresentado como uma vertical do gráfico de barras, onde cada barra representa um íon de ter uma massa específica-para-relação da carga (m/z) e o comprimento da barra indica a abundância relativa dos iões. Ao íon mais intenso é atribuída uma abundância de 100, e é referido como o pico base. A maioria dos íons formados em um espectrômetro de massa tem uma única carga, então o valor m/z é equivalente à própria massa., Espectrômetros de massa modernos facilmente distinguem (resolvem) íons diferentes por apenas uma única unidade de massa atômica, e assim fornecem valores completamente precisos para a massa molecular de um composto. O íon de maior massa em um espectro é normalmente considerado como sendo o íon molecular, e íons de menor massa são fragmentos do íon molecular, assumindo que a amostra é um único composto puro.a massa atômica é dada em termos da unidade de massa atômica unificada (símbolo: μ) Ou dalton (símbolo: Da). Nos últimos anos, houve uma mudança gradual no sentido de usar o dalton em vez da unidade de massa atómica unificada., O dalton é classificado como uma”unidade não SI cujos valores em unidades SI devem ser obtidos experimentalmente”. É definido como um duodécimo da massa restante de um átomo de carbono-12 não ligado em seu estado nuclear e eletrônico do solo, e tem um valor de 1.660538782(83)x10-27 kg.o diagrama seguinte mostra os espectros de massa de três compostos gasosos simples, dióxido de carbono, propano e ciclopropano. As moléculas destes compostos são semelhantes em tamanho, CO2 e C3H8 ambos têm uma massa nominal de 44 Da, E C3H6 tem uma massa de 42 Da., O íon molecular é o íon mais forte no espectro de CO2 e C3H6, e é moderadamente forte no propano. A resolução da massa da unidade é facilmente aparente nestes espectros (note-se a separação de íons com M/z=39, 40, 41 e 42 no espectro ciclopropano). Embora estes compostos sejam muito semelhantes em tamanho, é uma matéria simples identificá-los a partir de seus espectros de massa individuais. Clicando em cada espectro por sua vez, uma análise de fragmentação parcial e atribuição de pico será exibida., Mesmo com compostos simples como estes, deve-se notar que raramente é possível explicar a origem de todos os íons fragmentos em um espectro. Além disso, a estrutura da maioria dos íons fragmentos é raramente conhecida com certeza.
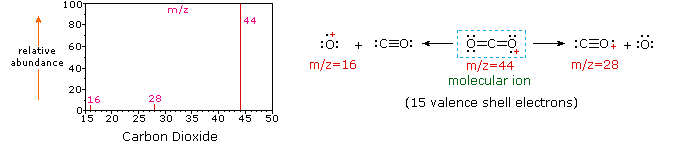

uma vez que uma molécula de dióxido de carbono é composto de apenas três átomos, o seu espectro de massa é muito simples. O íon molecular é também o pico base, e os únicos íons fragmentos são CO (m/z=28) e O (m/z=16)., O íon molecular do propano também tem m / z = 44, mas não é o íon mais abundante no espectro. A clivagem de uma ligação carbono-carbono dá fragmentos de metil e etil, um dos quais é um carbocation e o outro um radical. Ambas as distribuições são observadas, mas o maior cátion de etila (m/z=29) é o mais abundante, possivelmente porque seu tamanho proporciona maior dispersão de carga. Uma clivagem de ligação similar no ciclopropano não dá dois fragmentos, então o íon molecular é mais forte do que no propano, e é de fato responsável pelo pico base., A perda de um átomo de hidrogênio, antes ou depois da abertura do anel, produz o cátion alilo estável (m/z=41). O terceiro íon mais forte do espectro tem m / z = 39 (C3H3). Sua estrutura é incerta, mas duas possibilidades são mostradas no diagrama. O íon m/z=39 no propano e a ausência de um íon m/z=29 no ciclopropano são particularmente significativos na distinção destes hidrocarbonetos.
a maioria dos compostos orgânicos estáveis tem um número par de elétrons totais, refletindo o fato de que os elétrons ocupam orbitais atômicos e moleculares em pares., Quando um único elétron é removido de uma molécula para dar um íon, a contagem total de elétrons torna-se um número ímpar, e nos referimos a íons como catiões radicais. O íon molecular em um espectro de massa é sempre um cátion radical, mas os íons fragmentos podem ser cátions elétrons pares ou cátions radicais de elétrons ímpares, dependendo do fragmento neutro perdido. As fragmentações mais simples e mais comuns são clivagens de ligação produzindo um radical neutro (número ímpar de elétrons) e um catião com um número par de elétrons., Uma fragmentação menos comum, na qual um fragmento neutro de elétrons pares é perdido, produz um íon do fragmento de catião radical de elétrons ímpares. Os próprios íons fragmentos podem fragmentar-se ainda mais. Como regra, iões de elétrons ímpares podem se fragmentar para íons ímpares ou mesmo de elétrons, mas íons even-elétrons fragmentam apenas para outros íons even-elétrons. As massas de íons moleculares e fragmentos também refletem a contagem de elétrons, dependendo do número de átomos de nitrogênio na espécie.,
|
Íons com qualquer azoto |
ímpar de elétrons íons |
mesmo-de elétrons íons |
|---|---|---|
|
Íons ter uma |
ímpar de elétrons íons |
mesmo-de elétrons íons |
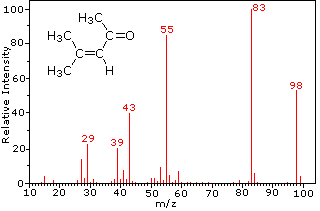
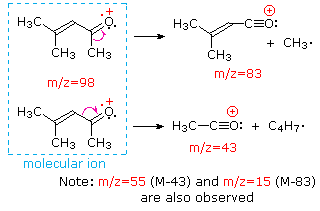
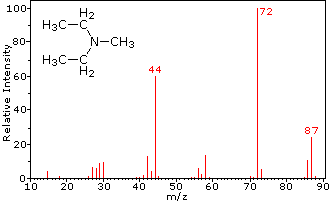
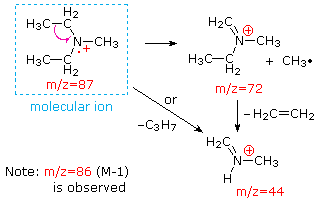
Esta distinção é bem ilustrado pelos seguintes exemplos., A cetona insaturada, 4-metil-3-penteno-2-ona, à esquerda não tem nitrogênio, de modo que a massa do íon molecular (m/z = 98) é um número par. A maioria dos íons fragmentos têm massas ímpares numeradas e, portanto, são catiões pares de elétrons. A dietilmetilamina, por outro lado, tem um nitrogênio e sua massa molecular (m/z = 87) é um número ímpar. A maioria dos íons fragmentos tem massas pares (íons em m/z = 30, 42, 56 & 58 não são rotulados), e são catiões de nitrogênio par-elétrons., Os íons even-electrões fracos A m / z = 15 e 29 devem-se a catiões metilo e etilo (sem átomos de azoto). As fragmentações que conduzem aos íons principais dos fragmentos serão exibidas clicando no espectro apropriado. Os cliques repetidos irão rodar o ecrã.,
|
|
|
|
|
4-methyl-3-pentene-2-one |
N,N-diethylmethylamine |
|---|
When non-bonded electron pairs are present in a molecule (e.g., on N or o), fragmentation pathways may sometimes be explained by assuming the missing electron is partially localized on that atom. Alguns desses mecanismos são mostrados acima. A clivagem de Bond gera um radical e uma cátion, e ambos os fragmentos frequentemente compartilham esses papéis, embora de forma desigual.