La Natura di Spettri di Massa
Uno spettro di massa di solito essere presentato come un grafico a barre verticali, in cui ogni barra rappresenta uno ione avendo un peso specifico-per-rapporto della carica (m/z) e la lunghezza della barra indica l’abbondanza relativa degli ioni. Lo ion più intenso è assegnato un’abbondanza di 100, ed è indicato come il picco di base. La maggior parte degli ioni formati in uno spettrometro di massa ha una singola carica, quindi il valore m/z è equivalente alla massa stessa., I moderni spettrometri di massa distinguono facilmente (risolvono) ioni che differiscono solo da una singola unità di massa atomica, e quindi forniscono valori completamente accurati per la massa molecolare di un composto. Lo ion di massa più alta in uno spettro è normalmente considerato lo ion molecolare e gli ioni di massa inferiore sono frammenti dello ion molecolare, supponendo che il campione sia un singolo composto puro.
La massa atomica è data in termini di unità di massa atomica unificata (simbolo: μ) o dalton (simbolo: Da). Negli ultimi anni c’è stato un graduale cambiamento verso l’utilizzo del dalton in preferenza all’unità di massa atomica unificata., Il dalton è classificato come “unità non-SI i cui valori in unità SI devono essere ottenuti sperimentalmente”. È definito come un dodicesimo della massa a riposo di un atomo non legato di carbonio-12 nel suo stato fondamentale nucleare ed elettronico e ha un valore di 1,660538782(83)x10-27 kg.
Il seguente diagramma mostra gli spettri di massa di tre semplici composti gassosi, anidride carbonica, propano e ciclopropano. Le molecole di questi composti sono di dimensioni simili, CO2 e C3H8 hanno entrambi una massa nominale di 44 Da e C3H6 ha una massa di 42 Da., Lo ion molecolare è lo ion più forte negli spettri di CO2 e C3H6 ed è moderatamente forte nel propano. La risoluzione di massa unitaria è facilmente evidente in questi spettri (si noti la separazione di ioni aventi m/z=39, 40, 41 e 42 nello spettro del ciclopropano). Anche se questi composti sono di dimensioni molto simili, è semplice identificarli dai loro singoli spettri di massa. Facendo clic su ogni spettro a sua volta, verrà visualizzata un’analisi di frammentazione parziale e l’assegnazione del picco., Anche con composti semplici come questi, va notato che raramente è possibile spiegare l’origine di tutti gli ioni del frammento in uno spettro. Inoltre, la struttura della maggior parte degli ioni di frammenti è raramente nota con certezza.
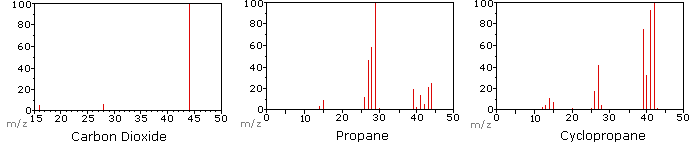
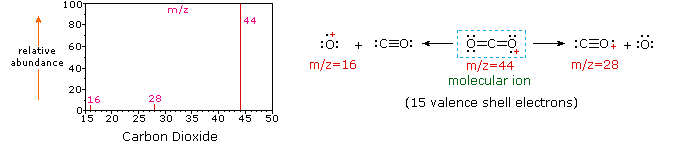

Poiché una molecola di anidride carbonica è composta da soli tre atomi, il suo spettro di massa è molto semplice. Lo molecular molecolare è anche il picco di base e gli unici ioni di frammento sono CO (m/z=28) e O (m/z=16)., Lo ion molecolare del propano ha anche m / z=44, ma non è lo ion più abbondante nello spettro. La scissione di un legame carbonio-carbonio dà frammenti di metile ed etile, uno dei quali è un carbocation e l’altro un radicale. Si osservano entrambe le distribuzioni, ma il catione etilico più grande (m/z=29) è il più abbondante, probabilmente perché la sua dimensione offre una maggiore dispersione di carica. Una scissione di legame simile nel ciclopropano non dà due frammenti, quindi lo ion molecolare è più forte che nel propano ed è infatti responsabile del picco di base., La perdita di un atomo di idrogeno, prima o dopo l’apertura dell’anello, produce il catione allilico stabile (m/z=41). Il terzo ion più forte nello spettro ha m / z = 39 (C3H3). La sua struttura è incerta, ma due possibilità sono mostrate nel diagramma. Il piccolo ion m/z=39 nel propano e l’assenza di uno ion m/z=29 nel ciclopropano sono particolarmente significativi nel distinguere questi idrocarburi.
La maggior parte dei composti organici stabili ha un numero pari di elettroni totali, riflettendo il fatto che gli elettroni occupano orbitali atomici e molecolari a coppie., Quando un singolo elettrone viene rimosso da una molecola per dare uno ion, il conteggio totale degli elettroni diventa un numero dispari, e ci riferiamo a tali ioni come cationi radicali. Lo spectrum molecolare in uno spettro di massa è sempre un catione radicale, ma gli ioni di frammento possono essere cationi di elettroni pari o cationi radicali di elettroni dispari, a seconda del frammento neutro perso. Le frammentazioni più semplici e più comuni sono le fenditure di legame che producono un radicale neutro (numero dispari di elettroni) e un catione con un numero pari di elettroni., Una frammentazione meno comune, in cui si perde un frammento neutro di elettroni pari, produce uno fragment frammento cationico radicale di elettroni dispari. Gli ioni frammenti stessi possono frammentarsi ulteriormente. Di norma, gli ioni di elettroni dispari possono frammentarsi in ioni di elettroni dispari o pari, ma gli ioni di elettroni pari si frammentano solo in altri ioni di elettroni pari. Le masse di ioni molecolari e frammenti riflettono anche il numero di elettroni, a seconda del numero di atomi di azoto nella specie.,
|
Ioni con nessun azoto |
dispari di elettroni, ioni |
-di elettroni, ioni |
|---|---|---|
|
Ioni aventi un |
dispari di elettroni, ioni |
-di elettroni, ioni |
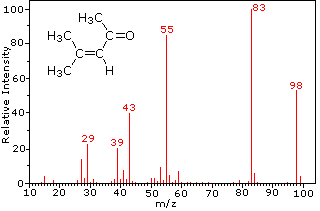
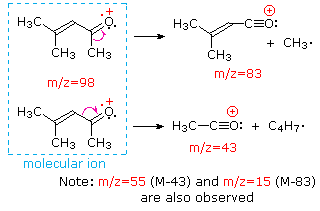
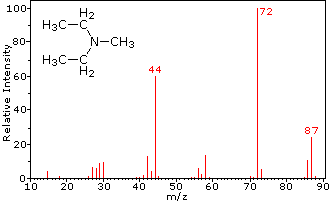
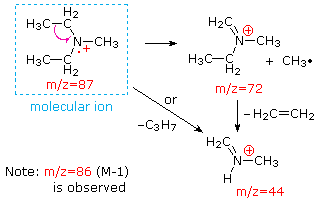
Questa distinzione è ben illustrato dai seguenti due esempi., Il chetone insaturo, 4-metil-3-pentene-2-one, a sinistra non ha azoto quindi la massa dello ion molecolare (m / z = 98) è un numero pari. La maggior parte degli ioni frammento hanno masse dispari, e quindi sono cationi di elettroni pari. La dietilmetilammina, d’altra parte, ha un azoto e la sua massa molecolare (m/z = 87) è un numero dispari. La maggior parte degli ioni frammenti ha masse pari (gli ioni a m/z = 30, 42, 56 & 58 non sono etichettati) e sono cationi di azoto a elettroni pari., I deboli ioni di elettroni pari a m / z=15 e 29 sono dovuti ai cationi metile ed etilico (senza atomi di azoto). Le frammentazioni che portano agli ioni del frammento principale verranno visualizzate facendo clic sullo spettro appropriato. Clic ripetuti faranno scorrere il display.,
|
|
|
|
|
4-methyl-3-pentene-2-one |
N,N-diethylmethylamine |
|---|
When non-bonded electron pairs are present in a molecule (e.g., su N o O), i percorsi di frammentazione possono talvolta essere spiegati assumendo che l’elettrone mancante sia parzialmente localizzato su quell’atomo. Alcuni di questi meccanismi sono mostrati sopra. La scissione del legame genera un radicale e un catione, ed entrambi i frammenti spesso condividono questi ruoli, anche se in modo ineguale.