la naturaleza de los espectros de masas
un espectro de masas generalmente se presentará como un gráfico de barras vertical, en el que cada barra representa un ion que tiene una relación masa-carga específica (m/z) y la longitud de la barra indica la abundancia relativa del ion. Al ion más intenso se le asigna una abundancia de 100, y se le conoce como el pico base. La mayoría de los iones formados en un espectrómetro de masas tienen una sola carga, por lo que el valor m/z es equivalente a la masa misma., Los espectrómetros de masas modernos distinguen fácilmente (resolve) iones que difieren en una sola unidad de masa atómica, y por lo tanto proporcionan valores completamente precisos para la masa molecular de un compuesto. El ion de mayor masa en un espectro normalmente se considera que es el ion molecular, y los iones de menor masa son fragmentos del ion molecular, suponiendo que la muestra es un solo compuesto puro.la masa atómica se da en términos de la unidad de masa atómica unificada (símbolo: μ) O dalton (símbolo: Da). En los últimos años ha habido un cambio gradual hacia el uso del dalton en preferencia a la unidad de masa atómica unificada., El dalton se clasifica como una»unidad no SI cuyos valores en unidades SI deben obtenerse experimentalmente». Se define como una doceava parte de la masa en reposo de un átomo no Unido de carbono-12 en su estado fundamental nuclear y electrónico, y tiene un valor de 1,660538782(83)x10-27 kg.
el siguiente diagrama muestra los espectros de masa de tres compuestos gaseosos simples, dióxido de carbono, propano y ciclopropano. Las moléculas de estos compuestos son similares en tamaño, CO2 y C3H8 ambos tienen una masa nominal de 44 Da, y C3H6 tiene una masa de 42 Da., El ion molecular es el ion más fuerte en los espectros de CO2 y C3H6, y es moderadamente fuerte en propano. La resolución unitaria de masa es fácilmente aparente en estos espectros (Nótese la separación de iones que tienen m/z=39, 40, 41 y 42 en el espectro ciclopropano). A pesar de que estos compuestos son muy similares en tamaño, es una cuestión simple para identificarlos a partir de sus Espectros de masa individuales. Al hacer clic en cada espectro a su vez, se mostrará un análisis de fragmentación parcial y la asignación de picos., Incluso con compuestos simples como estos, debe tenerse en cuenta que rara vez es posible explicar el origen de todos los iones fragmentos en un espectro. Además, la estructura de la mayoría de los iones fragmentos rara vez se conoce con certeza.
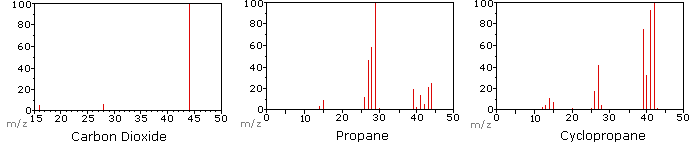
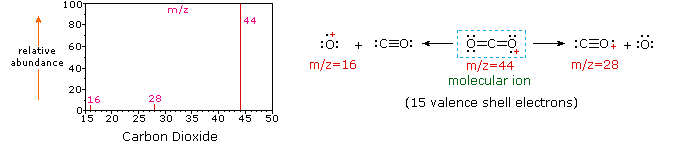

Puesto que una molécula de dióxido de carbono sólo se compone de tres átomos, su espectro de masas es muy simple. El ion molecular es también el pico base, y los únicos iones fragmentos son CO (m / z=28) y O (m/z=16)., El ion molecular del propano también tiene m/z=44, pero no es el ion más abundante en el espectro. La escisión de un enlace carbono-carbono da fragmentos de metilo y etilo, uno de los cuales es un carbocatión y el otro un radical. Ambas distribuciones se observan, pero el catión de etilo más grande (m/z=29) es el más abundante, posiblemente porque su tamaño permite una mayor dispersión de la carga. Una escisión de enlace similar en ciclopropano no da dos fragmentos, por lo que el ion molecular es más fuerte que en propano, y es de hecho responsable del pico de la base., La pérdida de un átomo de hidrógeno, ya sea antes o después de la apertura del anillo, produce el catión alílico estable (m/z=41). El tercer ion más fuerte en el espectro tiene m / z = 39 (C3H3). Su estructura es incierta, pero en el diagrama se muestran dos posibilidades. El pequeño ion M / z=39 en propano y la ausencia de un ion m/z = 29 en ciclopropano son particularmente significativos para distinguir estos hidrocarburos.
la mayoría de los compuestos orgánicos estables tienen un número par de electrones Totales, lo que refleja el hecho de que los electrones ocupan orbitales atómicos y moleculares en pares., Cuando un solo electrón es removido de una molécula para dar un ion, el conteo total de electrones se convierte en un número impar, y nos referimos a tales iones como cationes radicales. El ion molecular en un espectro de masa es siempre un catión radical, pero los iones fragmento pueden ser cationes de electrones pares o cationes radicales de electrones impares, dependiendo del fragmento neutro perdido. Las fragmentaciones más simples y más comunes son las divisiones de enlace que producen un radical neutro (número impar de electrones) y un catión que tiene un número par de electrones., Una fragmentación menos común, en la que se pierde un fragmento neutro de electrones pares, produce un fragmento de catión radical de electrones impares. Los iones fragmentos pueden fragmentarse aún más. Como regla general, los iones de electrones impares pueden fragmentarse en iones de electrones impares o pares, pero los iones de electrones pares solo se fragmentan en otros iones de electrones pares. Las masas de iones moleculares y fragmentos también reflejan el recuento de electrones, dependiendo del número de átomos de nitrógeno en la especie.,
|
Iones con ninguna de nitrógeno |
impar de electrones de los iones |
incluso de electrones de los iones |
|---|---|---|
|
Iones que tienen una |
impar de electrones de los iones |
incluso de electrones de los iones |
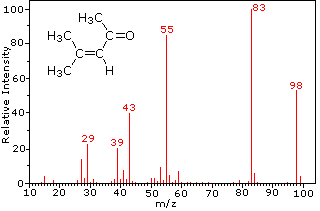
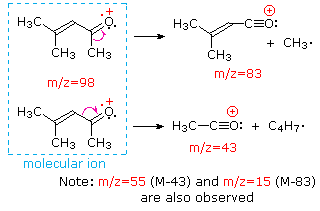
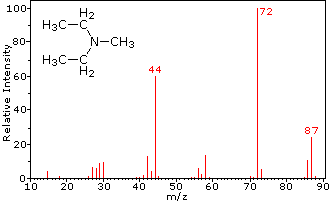
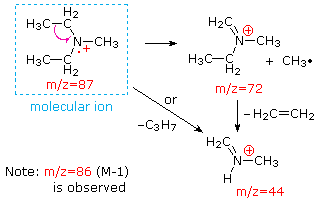
Esta distinción se ilustra muy bien por los siguientes dos ejemplos., La cetona insaturada, 4-metil-3-penteno-2-one, a la izquierda no tiene nitrógeno, por lo que la masa del ion molecular (m/z = 98) es un número par. La mayoría de los iones fragmentos tienen masas impares, y por lo tanto son cationes de electrones pares. La dietilmetilamina, por otro lado, tiene un nitrógeno y su masa molecular (m/z = 87) es un número impar. La mayoría de los iones de fragmento tienen masas pares (los iones A m/z = 30, 42, 56 & 58 no están etiquetados), y son cationes de nitrógeno de electrones pares., Los iones de electrones pares débiles en m/z=15 y 29 se deben a cationes de metilo y etilo (sin átomos de nitrógeno). Las fragmentaciones que conducen a los iones principales del fragmento se mostrarán haciendo clic en el espectro apropiado. Los clics repetidos ciclarán la visualización.,
|
|
|
|
|
4-methyl-3-pentene-2-one |
N,N-diethylmethylamine |
|---|
When non-bonded electron pairs are present in a molecule (e.g., en N u O), las vías de fragmentación a veces pueden explicarse asumiendo que el electrón faltante está parcialmente localizado en ese átomo. A few such mechanisms are shown above. La escisión del vínculo genera un radical y un catión, y ambos fragmentos a menudo comparten estos roles, aunque de manera desigual.