Natura Spectrelor de Masă
Un spectru de masă va fi, de obicei prezentate ca un grafic cu bare verticale, în care fiecare bară reprezintă un ion care are o anumită masă-la-încărcare (raportul m/z) și lungimea de la bara indică abundența relativă de ion. Ionul cel mai intens este atribuit o abundență de 100 și este denumit vârful de bază. Majoritatea ionilor formați într-un spectrometru de masă au o singură încărcare, astfel încât valoarea m/z este echivalentă cu masa în sine., Spectrometrele de masă moderne disting cu ușurință (rezolvă) ionii care diferă printr-o singură unitate de masă atomică și oferă astfel valori complet precise pentru masa moleculară a unui compus. Ionul cu cea mai mare masă dintr-un spectru este în mod normal considerat a fi ionul molecular, iar ionii cu masă inferioară sunt fragmente din ionul molecular, presupunând că proba este un singur compus pur.
masa atomică este dată în termeni de unitate unificată de masă atomică (simbol: μ) sau dalton (simbol: Da). În ultimii ani a existat o schimbare treptată spre utilizarea dalton în preferința pentru unitatea de masă atomică unificată., Dalton este clasificat ca o „unitate non-SI ale cărei valori în unități SI trebuie obținute experimental”. Acesta este definit ca o douăsprezecime din masa de odihnă a unui atom nelegat de carbon-12 În starea sa nucleară și electronică la sol și are o valoare de 1.660538782(83)x10-27 kg.
următoarea diagramă afișează spectrele de masă a trei compuși gazoși simpli, dioxid de carbon, propan și ciclopropan. Moleculele acestor compuși au dimensiuni similare, CO2 și C3H8 ambele au o masă nominală de 44 Da, iar C3H6 are o masă de 42 Da., Ionul molecular este cel mai puternic ion din spectrele CO2 și C3H6 și este moderat puternic în propan. Rezoluția masei unitare este evidentă în aceste spectre (rețineți separarea ionilor având m/z=39, 40, 41 și 42 în spectrul ciclopropanului). Chiar dacă acești compuși au dimensiuni foarte similare, este o chestiune simplă identificarea lor din spectrele lor individuale de masă. Făcând clic pe fiecare spectru pe rând, va fi afișată o analiză parțială a fragmentării și o atribuire de vârf., Chiar și cu compuși simpli ca aceștia, trebuie remarcat faptul că rareori este posibil să se explice originea tuturor ionilor de fragment dintr-un spectru. De asemenea, structura majorității ionilor de fragmente este rareori cunoscută cu certitudine.
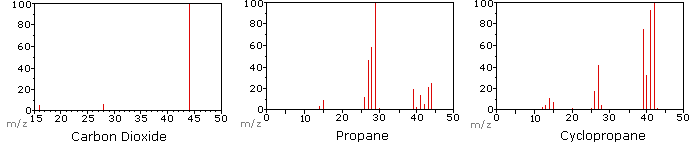
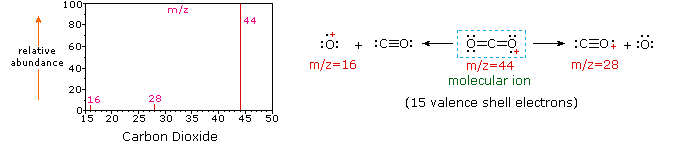

Când o moleculă de dioxid de carbon este compus din doar trei atomi, masa sa spectru este foarte simplu. Ionul molecular este, de asemenea, vârful de bază, iar singurii ioni de fragment sunt CO (M/z=28) și O (m/z=16)., Ionul molecular al propanului are, de asemenea, m/z=44, dar nu este cel mai abundent ion din spectru. Scindarea unei legături carbon-carbon dă fragmente de metil și etil, dintre care unul este o carbocație, iar celălalt un radical. Ambele distribuții sunt observate, dar cationul de etil mai mare (m / z=29) este cel mai abundent, posibil deoarece dimensiunea sa oferă o dispersie mai mare a încărcăturii. O scindare similară a legăturii în ciclopropan nu dă două fragmente, deci ionul molecular este mai puternic decât în propan și este de fapt responsabil pentru vârful de bază., Pierderea unui atom de hidrogen, înainte sau după deschiderea inelului, produce cationul de alil stabil (m/z=41). Al treilea cel mai puternic ion din spectru are m/z=39 (C3H3). Structura sa este incertă, dar două posibilități sunt prezentate în diagramă. Ionul mic m / z = 39 în propan și absența unui ion m/z=29 în ciclopropan sunt deosebit de semnificative în diferențierea acestor hidrocarburi.
cele Mai stabile compuși organici au un număr total de electroni, reflectând faptul că electronii ocupă atomice și orbitali moleculari în perechi., Când un singur electron este îndepărtat dintr-o moleculă pentru a da un ion, numărul total de electroni devine un număr impar și ne referim la astfel de ioni ca cationi radicali. Ionul molecular dintr-un spectru de masă este întotdeauna un cation radical, dar ionii fragmentului pot fi fie cationi de electroni egali, fie cationi radicali de electroni impari, în funcție de fragmentul neutru pierdut. Cele mai simple și mai frecvente fragmentări sunt scindările de legătură care produc un radical neutru (număr impar de electroni) și un cation având un număr par de electroni., O fragmentare mai puțin frecventă, în care se pierde un fragment neutru de electroni uniform, produce un fragment de cation radical de electroni ciudat. Ionii de fragmente se pot fragmenta în continuare. De regulă, ionii de electroni impari se pot fragmenta fie la ionii de electroni impari, fie par, dar ionii de electroni par se fragmentează numai la alți ioni de electroni uniformi. Masele de ioni moleculari și fragment reflectă, de asemenea, numărul de electroni, în funcție de numărul de atomi de azot din specie.,
|
Ioni cu nr de azot |
impar de electroni, ioni |
chiar electroni-ioni |
|---|---|---|
|
Ioni având o |
impar de electroni, ioni |
chiar electroni-ioni |
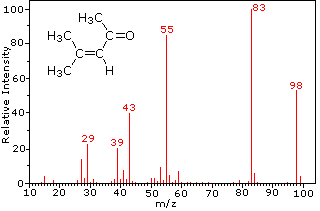
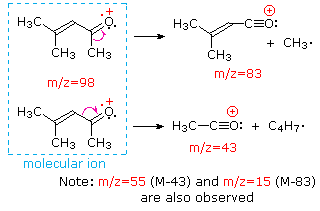
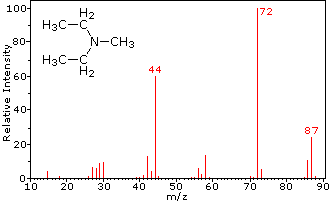
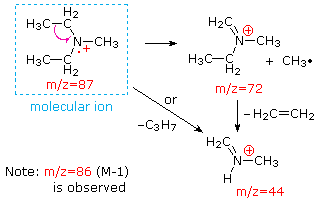
Această distincție este frumos ilustrat prin urmatoarele doua exemple., Cetona nesaturată, 4-metil-3-penten-2-onă, din stânga nu are azot, astfel încât masa ionului molecular (m/z = 98) este un număr par. Majoritatea ionilor de fragment au mase impare și, prin urmare, sunt cationi de electroni. Dietilmetilamina, pe de altă parte, are un azot, iar masa sa moleculară (m/z = 87) este un număr impar. Majoritatea ionilor de fragment au mase cu număr egal (ionii la m/z = 30, 42, 56 & 58 nu sunt etichetați) și sunt cationi de azot uniform-electroni., Ionii slabi de electroni uniformi la m / z=15 și 29 se datorează cationilor de metil și etil (fără atomi de azot). Fragmentările care conduc la ionii de fragmente principale vor fi afișate făcând clic pe spectrul corespunzător. Clicurile repetate vor cicliza afișajul.,
|
|
|
|
|
4-methyl-3-pentene-2-one |
N,N-diethylmethylamine |
|---|
When non-bonded electron pairs are present in a molecule (e.g., pe N sau O), căile de fragmentare pot fi uneori explicate presupunând că electronul lipsă este parțial localizat pe acel atom. Câteva astfel de mecanisme sunt prezentate mai sus. Scindarea legăturilor generează un radical și un cation, iar ambele fragmente împărtășesc adesea aceste roluri, deși inegal.