La displasia fibromuscolare (FMD) è una malattia vascolare idiopatica, non infiammatoria, non aterosclerotica delle arterie di piccole e medie dimensioni.1,2 Da quando è stato identificato per la prima volta nel 1938, la FMD è stata descritta praticamente in ogni letto arterioso, ma colpisce più comunemente le arterie carotidi renali ed extracraniche. Questo articolo si concentra sulla FMD cerebrovascolare, i sintomi neurologici comuni associati alla FMD e la relazione tra FMD e ictus.,
Epidemiologia
Poiché la FMD è comunemente identificata in individui asintomatici, individuare la prevalenza esatta e la storia naturale è difficile. Secondo il registro FMD degli Stati Uniti, l’età media alla diagnosi è di 51,9, il 90% delle persone con diagnosi di FMD sono donne, il 72% ha ipertensione e il 60% ha mal di testa significativi.3 Una minoranza di persone con FMD riporta un parente stretto con FMD, sebbene circa l ‘ 80% dei parenti di primo o secondo grado abbia ipertensione e il 53,5% riferisca una storia di ictus., È altrettanto comune che la FMD colpisca le arterie renali e cerebrocervicali, con circa una coprevalenza del 65%.3 Moderna CT-angiografia (CTA) e contrasto-enhanced angiografia a risonanza magnetica (MRA) hanno migliorato la caratterizzazione radiografica e la diagnosi di FMD. Tra gli individui con FMD cerebrocervicale, il 95% ha coinvolgimento carotideo, spesso bilateralmente, e il 70% ha coinvolgimento delle arterie vertebrali.,4
Fisiopatologia e genetica
La fisiopatologia della FMD è poco conosciuta, sebbene l’evidenza istologica suggerisca che una trasformazione difettosa dei fibroblasti delle cellule muscolari lisce porti alla degradazione delle lamine elastiche, alla sintesi aberrante del collagene e alla fibroplasia segmentale.5 Adulti più comunemente hanno fibroplasia mediale piuttosto che altri sottotipi istologici.4,6 Forti evidenze supportano l’ereditabilità della FMD con elevata coprevalenza di FMD nei gemelli e nei parenti di primo grado, sebbene non siano note forme monogeniche.,4 Recenti genome-wide association studies identificato il primo gene locus associato con il virus dell’afta epizootica, un polimorfismo a singolo nucleotide (rs9349379) della fosfatasi e actina regolatore 1 gene (PHACTR1) sul cromosoma 6.7 Questa variante è anche associato con l’emicrania, la dissezione dell’arteria cervicale (CeAD), spontanea e dissezione dell’arteria coronaria, ed è inversamente associato con ateroma malattia coronarica e calcificazione.8 La variante PHACTR1 è nota per regolare l’espressione dell’endotelina-1, un vasocostrittore endogeno.,9
Presentazione e diagnosi
La presentazione clinica della FMD dipende dal letto vascolare interessato (Figura 1). In tutte le località, i 3 sintomi più comuni che presentano includono ipertensione, mal di testa e tinnito pulsatile.3 Il sintomo più comune che presenta di FMD cerebrocervical è tinnito pulsatile, descritto spesso come whooshing nell’orecchio. Un bruit carotideo può spesso essere auscultato all’esame fisico, correlando con il flusso turbolento nelle arterie cervicali colpite. Nelle persone affette da FMD cerebrovascolare, il 70% ha mal di testa, con il 30% o più caratterizzato come emicrania., Le persone con FMD cerebrocervicale possono anche essere diagnosticate in concomitanza con la dissezione dell’arteria cervicale, presentandosi con o senza attacco ischemico transitorio (TIA) o ictus.
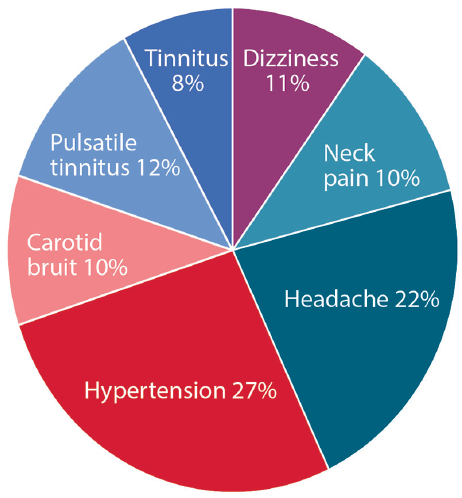
Fare clic per visualizzare ingrandito
Figura 1. Comparsa dei più comuni segni e sintomi di displasia fibromuscolare.
La diagnosi e la classificazione della FMD si basano sull’aspetto angiografico., La FMD multifocale rappresenta il 90% dei casi ed è caratterizzata da un aspetto di stringa di perline che rappresenta una dilatazione arteriosa alternata e una costrizione (Figura 2). La FMD focale rappresenta il 10% dei casi ed è caratterizzata da un restringimento uniforme concentrico o tubolare,10 più spesso nei segmenti medio e distale dell’arteria carotide interna e nel segmento V3-V4 delle arterie vertebrali. La FMD intracranica è rara e più diffusa nei bambini con sottotipi di FMD intimale.5 Non è richiesta una particolare modalità di imaging per la diagnosi, ma CTA o MRA sono utilizzati più frequentemente.,10 L’arteriografia digitale a sottrazione (DSA) è l’imaging standard per la diagnosi, ma è più invasiva, in particolare per le persone con FMD che possono essere più a rischio di dissezione iatrogena. L’ecografia duplex può essere utile per la diagnosi e il monitoraggio della FMD carotidea. Tuttavia, la FMD esiste spesso nel segmento medio o distale delle arterie carotidi e l’ecografia è meno sensibile per valutare le arterie vertebrali cervicali.
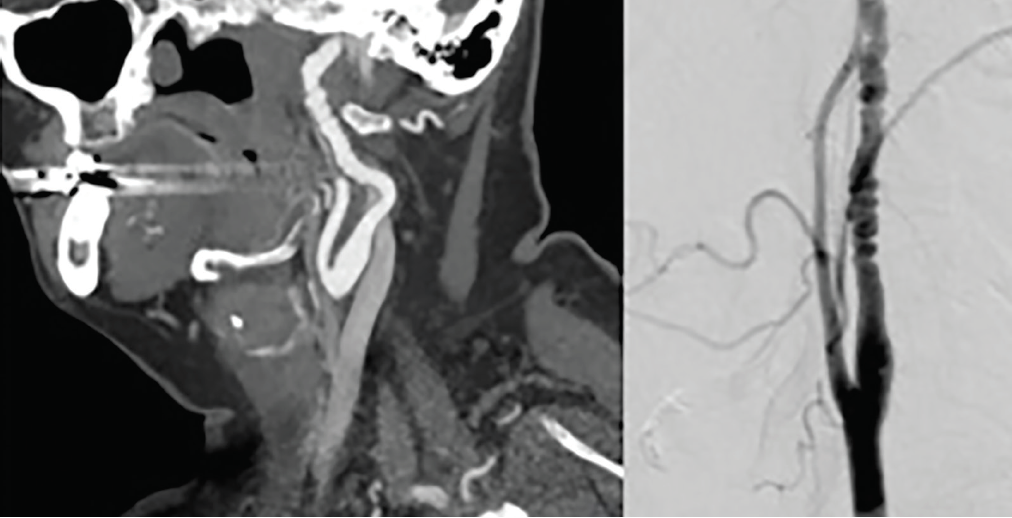
Fare clic per visualizzare ingrandito
Figura 2., Displasia fibromuscolare dell’arteria carotide. Un angiogramma CT (a sinistra) e un angiogramma di sottrazione digitale (a destra) dimostrano l’aspetto principale con stenosi alternate e dilatazione coerente con displasia fibromuscolare (FMD) nell’arteria carotide interna midcervicale.
Manifestazioni neurologiche
La storia naturale osservata di FMD in casi asintomatici diagnosticati incidentalmente è relativamente benigna.,1 Tuttavia, in alcuni casi la diagnosi iniziale di FMD è fatta nell’impostazione dell’ictus, che come manifestazione di FMD, è più spesso a causa della concomitante dissezione dell’arteria cervicale (CeAD). Rispetto alla popolazione generale, la FMD è associata ad una maggiore prevalenza di aneurismi intracranici, in particolare nelle donne. Nel registro di FMD degli Stati Uniti, oltre il 40% delle persone con FMD riferisce con CeAD associato o aneurisma, anche se questa è probabilmente una sopravvalutazione della vera storia naturale dato rinvio e campionamento bias in questa popolazione.11
Emicrania., La manifestazione neurologica più comune di FMD è l’emicrania. Quasi l ‘ 80% degli individui con FMD cerebrocervicale riporta mal di testa, più comunemente emicrania.12,13 La relazione tra cefalea e FMD è poco conosciuta e probabilmente multifattoriale. I meccanismi proposti includono il flusso sanguigno cerebrovascolare non laminare, l’ipertensione incontrollata, la disregolazione della regolazione simpatica nella parete dell’arteria cervicale o l’aumentata sensibilità al dolore durale. L’emicrania refrattaria può anche manifestarsi come sintomo presentante o sequela residua di CeAD.,13 Dal punto di vista clinico, i sintomi neurologici transitori nella FMD derivanti dall’aura emicranica sono spesso mal diagnosticati come TIA e richiedono un’attenta valutazione per guidare la gestione.
Dissezione dell’arteria cervicale (CeAD). La definizione di CeAD è la presenza di un ematoma murale nella parete di un’arteria cervicale (carotide o vertebrale) derivante da una lacrima intimale o sanguinamento diretto all’interno della parete secondaria a una rottura vasa vasorum.,14 L’incidenza stimata di CeAD nella popolazione generale è da 2 a 3 per 100.000, sebbene l’incidenza effettiva sia probabilmente più elevata nelle persone con FMD e altre vasculopatie predisponenti del tessuto connettivo.15,16 Coprevalenza di CeAD e FMD cerebrocervicale varia dal 5% al 15% negli studi osservazionali, ed è maggiore in quelli che presentano più CeAD.5,10,17 Circa il 70% di CeAD si presenta con ictus o TIA che spesso possono essere ritardati di giorni o settimane dalla dissezione arteriosa iniziale., L’ictus ischemico deriva più spesso dalla formazione di tromboemboli o dall’occlusione completa nel sito di dissezione. Raramente, una dissezione dell’arteria vertebrale che si estende nel segmento intradurale può manifestarsi come emorragia subaracnoidea (SAH).14
Inoltre, CeAD può presentare con altri sintomi focali neurologici, tra cui la sindrome di Horner parziale (cioè ptosi ipsilaterale e miosi) dall’interruzione dei tratti oculosimpatici ascendenti nell’arteria carotide interna. Non comunemente, le paralisi del nervo cranico inferiore (CN) si verificano da ischemia o lesioni correlate ai nervi glossofaringeo o vago., Al contrario, la dissezione dell’arteria vertebrale si presenta comunemente con una sindrome vestibolare acuta, con o senza ictus circolatorio posteriore che coinvolge il territorio dell’arteria cerebellare inferiore posteriore (PICA) e l’infarto midollare e/o cerebellare laterale. È importante riconoscere che in CeAD, le dissezioni carotidee o vertebrali spesso causano dolore ipsilaterale al viso o al collo di intensità moderata e un mal di testa non specifico che può imitare l’emicrania o la cefalea a grappolo.,14 A causa di questa associazione, l’incidenza di dolore acuto al collo o al viso con nuovi sintomi neurologici focali in una persona con FMD richiede una valutazione neurologica urgente e l’imaging vascolare cervicale per escludere CeAD.
Aneurismi intracranici. In qualsiasi sito arterioso, la FMD è associata ad una maggiore prevalenza di aneurismi intracranici (IA), in particolare nelle donne.,18,19 Nel registro di FMD degli Stati Uniti, il 13% delle donne che avevano imaging intracranico aveva almeno 1 IA e il 4% aveva più IAS, sebbene la prevalenza esatta nella popolazione generale con FMD sia sconosciuta a causa del bias di campionamento nei dati del registro. Il rischio di rottura di aneurisma può essere più alto in pazienti con FMD alle più piccole dimensioni, sebbene questo sia controverso. Come nella popolazione generale, il fumo è significativamente associato alla crescita e alla formazione di IA nelle persone con FMD.10,11,18 Non è chiaro se gli individui con FMD richiedano un monitoraggio angiografico più frequente per IAS non interrotti.,
Gestione
La gestione della FMD cerebrocervicale dipende in gran parte dai sintomi che presentano e da eventuali complicanze neurologiche associate come CeAD, emicrania o aneurisma. Mentre mancano le linee guida basate sull’evidenza, un’attenta comprensione dell’approccio diagnostico alla FMD e l’opinione degli esperti della guida alla storia naturale attesa e un’adeguata consulenza al paziente per quanto riguarda il loro rischio cerebrovascolare.
Mal di testa
La gestione del mal di testa in individui con o senza FMD è simile e in gran parte guidata da un’accurata caratterizzazione del sottotipo di cefalea., Anche la gestione dell’emicrania in quelli con o senza specchi di FMD è simile, considerando sia le strategie preventive che la terapia abortiva quando indicato. Tuttavia, una considerazione importante nei pazienti con FMD riguarda l’uso di farmaci abortivi vasoattivi, come ergot e triptani, che possono introdurre un rischio aggiuntivo nei pazienti già a rischio di ictus o dissezione.18 Ciò è di particolare preoccupazione per le persone con FMD e una storia concomitante di dissezione coronarica spontanea (SCAD), in cui i farmaci vasocostrittori come i triptani sono una controindicazione assoluta., Le terapie abortive alternative per l’emicrania acuta nella regolazione di FMD possono includere la classe antidopaminergic (per esempio, prochlorperazine, metoclopramide), o una breve conicità steroide. Le iniezioni della tossina botulinica possono anche essere efficaci per l’emicrania cronica refrattaria in FMD. Più recentemente, l’approvazione degli inibitori del peptide correlato al gene della calcitonina (CGRP) offre un’altra strategia possibilmente efficace per il trattamento dell’emicrania in FMD., Sebbene gli studi clinici che approvano questi nuovi agenti non abbiano rivelato effetti collaterali cardiovascolari o cerebrovascolari significativi, 20 ulteriori osservazioni longitudinali e pratica del mondo reale sono necessarie per verificarlo.
Dissezione dell’arteria cervicale
L’età mediana per l’incidenza di CeAD è nei primi anni ‘ 40, anche se le persone con FMD e altre vasculopatie del tessuto connettivo possono essere a rischio più elevato in età più giovane. Ictus e TIA sono associati a CeAD in circa il 70% dei casi e si verificano in genere nelle prime settimane postdissection., L’incidenza di ictus o TIA è spesso latente alla lesione arteriosa perché l’ematoma intramurale si espande e aumenta il rischio di tromboembolia intraluminale. Man mano che la nave guarisce per settimane o mesi, il rischio di ictus diminuisce con un rischio stimato a lungo termine di recidiva che varia dall ‘ 1% al 3%.21-23
Non ci sono ancora studi clinici che indagano il trattamento di CeAD specifico per la FMD, quindi la gestione è estrapolata dal trattamento di CeAD in generale., Il CADISS studya ha confrontato 3 a 6 mesi di terapia antipiastrinica con 3 a 6 mesi di anticoagulazione con warfarin e non ha mostrato alcuna differenza nella recidiva dell’ictus dopo l’evento iniziale di CeAD. Questo studio ha portato a una classe IIa, raccomandazione di livello B che equipara antiaggregante piastrinica e anticoagulante per 3-6 mesi dopo CeAD.24 Tuttavia, non vi è alcuna relazione sul numero di partecipanti a questo studio che hanno avuto anche FMD., Non ci sono stati studi robusti che studiassero specificamente l’uso di anticoagulanti orali ad azione diretta (ad esempio, apixaban, rivaroxaban o dabigatran) come prevenzione secondaria precoce in CeAD e FMD. Tuttavia, la terapia antipiastrinica può essere preferita a causa della sicurezza e della convenienza, a meno che non vi siano chiari trombo intraluminale o eventi tromboembolici ricorrenti nonostante la terapia antipiastrinica.
Non ci sono studi randomizzati sul trattamento endovascolare di CeAD nell’ambito della FMD., Tuttavia, poiché la stenosi del vaso che segue CeAD ricanalizza tipicamente senza la necessità di intervento, la terapia endovascolare dovrebbe essere riservata a coloro che hanno ipoperfusione cerebrale ricorrente o eventi tromboembolici nonostante la terapia antitrombotica ottimizzata.25 Persone con FMD possono anche essere a più alto rischio di dissezione iatrogena con interventi basati su catetere e questo dovrebbe essere preso in considerazione per quanto riguarda il rischio periprocedurale.,
Quelli con FMD a rischio di incidente o ricorrente CeAD si consiglia di evitare attività associate a iperestensione estrema o rotazione laterale del collo, in particolare chiropratica cervicale manipolazione spinale. Si deve prestare attenzione ad attutire il collo durante l’intervento chirurgico, gli appuntamenti dentali o altre attività prolungate con iperestensione forzata. L’esercizio di routine e le attività cardiovascolari non sono una controindicazione, a meno che non vi sia anche una storia di dissezione coronarica spontanea che richiede ulteriore moderazione.,
Ictus ischemico
L’insorgenza di ictus ischemico in individui con FMD in assenza di CeAD associato o altro meccanismo tromboembolico rimane controversa. Tuttavia, la gestione dell’ictus acuto nei pazienti con FMD deve seguire le linee guida standard per l’ictus.26 Ad esempio, una diagnosi nota di FMD non è una controindicazione alla terapia fibrinolitica o alla trombectomia meccanica in casi altrimenti ammissibili.,
Le persone con FMD e storia di ictus dovrebbero assumere farmaci antipiastrinici per la prevenzione secondaria, a meno che non vi sia un meccanismo di ictus concorrente che garantisca anticoagulanti come la fibrillazione atriale parossistica o uno stato ipercoagulabile. In particolare, le statine non sono indicate principalmente per la prevenzione dell’ictus secondario nelle persone con CeAD nell’ambito della FMD, e in effetti possono avere una relazione inversa con il rischio di dissezione arteriosa.27,28
FMD asintomatica
La FMD asintomatica quando scoperta incidentalmente ha una storia naturale favorevole., Indipendentemente da ciò, le dichiarazioni di consenso suggeriscono l’imaging vascolare 1-time dal cervello al bacino, con CTA o MRA, per lo screening di aneurismi, dissezioni e FMD in altri letti arteriosi.29 Per le persone con FMD e nessuna storia precedente di ictus, il beneficio a lungo termine della terapia antipiastrinica per la prevenzione primaria dell’ictus non è noto e deve essere valutato rispetto al rischio di sanguinamento a lungo termine.,
Sommario
Una rara vasculopatia non atherosclerotica non infiammatoria, la FMD colpisce più comunemente le arterie renali e cervicali, è molto più frequente nelle donne e viene diagnosticata incidentalmente su imaging vascolare o con sintomi di mal di testa e tinnito che si presentano nella mezza età. L’incidenza di ictus nella FMD è principalmente associata a CeAD e può essere gestita in modo conservativo con la terapia antiaggregante piastrinica ed evitare lo sforzo cervicale ad alto rischio. I pazienti con FMD devono anche essere considerati per lo screening e il monitoraggio della formazione e della crescita della IA., Ulteriori ricerche (Figura 3) sono necessarie per comprendere meglio la genetica, la fisiopatologia e il trattamento ottimale per i pazienti sintomatici con FMD e, auspicabilmente, per evitare complicazioni cerebrovascolari prevenibili.
Fare clic per visualizzare ingrandito
Figura 3. Una serie di priorità di ricerca farà progredire la comprensione della displasia fibromuscolare( FMD), lo sviluppo di terapie e strategie di screening e sorveglianza e la comprensione di quando evitare l’intervento., Sono necessari dati epidemiologici migliorati riguardanti la storia naturale della FMD, l’associazione con eventi cardiovascolari (ad esempio, ictus, dissezione e aneurisma) e fattori di rischio e sarà essenziale comprendere la fisiopatologia molecolare della FMD e la biologia condivisa e distinta in relazione ad altre arteriopatie non aterosclerotiche. Comprendere la genetica della FMD attraverso la ricerca su PHACTR1 e ulteriori contributori genetici al rischio di FMD sosterrà entrambi questi obiettivi., Queste priorità richiedono indagini in studi di coorte, studi basati sulla famiglia, indagini genomiche e di altro tipo e creazione di biobanche di sangue, plasma e tessuto vascolare.
a.
1. Olin JW, Gornik HL, Bacharach JM, et al. Displasia fibromuscolare: stato della scienza e domande critiche senza risposta: una dichiarazione scientifica dell’American Heart Association. Circolazione. 2014;129(9):1048-1078.
2. Palubinskas AJ, Ripley HR. Iperplasia fibromuscolare nelle arterie extrarenali. Radiologico. 1964;82:451-455.
3., Olin JW, Froehlich J, Gu X, et al. Il Registro degli Stati Uniti per la displasia fibromuscolare: risultati nei primi 447 pazienti. Circolazione. 2012;125(25):3182-3190.
4. Touze E, Oppenheim C, Trystram D, et al. Displasia fibromuscolare delle arterie cervicali e intracraniche. Int J Ictus. 2010;5(4):296-305.
5. Southerland AM, Meschia JF, Worrall BB. Associazioni condivise di arteriopatie non aterosclerotiche, a grandi vasi, cerebrovascolari: considerando aneurismi intracranici, dissezione dell’arteria cervicale, malattia di moyamoya e displasia fibromuscolare. Neurolo di Curr Opin. 2013;26(1):13-28.,
6. Stanley JC, Gewertz BL, Bove EL, Sottiurai V, Fry WJ. Fibrodisplasia arteriosa. Carattere istopatologico e concetti eziologici attuali. Arch Surg. 1975;110 (5): 561-566.
7. Kiando SR, Tucker NR, Castro-Vega LJ, et al. PHACTR1 è un locus di suscettibilità genetica per displasia fibromuscolare che sostiene il suo modello genetico complesso di eredità. PLoS Genet. 2016; 12:e1006367.
8. Di Monaco S, Georges A, Lengele JP, Vikkula M, Persu A. Genomica della displasia fibromuscolare. Int J Mol Sci. 2018;19 (5):pii:E1526.
9. Il sito utilizza cookie tecnici e di terze parti., Una variante genetica associata a cinque malattie vascolari è un regolatore distale dell’espressione genica dell’endotelina-1. Cellula. 2017;170 (3): 522-533,e15.
10. Touze E, Southerland AM, Boulanger M, et al. Displasia fibromuscolare e sue manifestazioni neurologiche: una revisione sistematica. JAMA Neurol. 2019;76(2):217-226.
11. Kadian-Dodov D, Gornik HL, Gu X, et al. Dissezione e aneurisma in pazienti con displasia fibromuscolare: risultati dal Registro degli Stati Uniti per FMD. J Am Coll Cardiol. 2016;68(2):176-185.
12. Mettinger KL, Ericson K. Displasia fibromuscolare e il cervello. Io., Osservazioni sulle caratteristiche angiografiche, cliniche e genetiche. Colpo. 1982;13:46-52.
13. O’Connor SC, Poria N, Gornik HL. Displasia fibromuscolare: un aggiornamento per il medico del mal di testa. Mal. 2015;55(5):748-755.
14. Debette S, Leys D. Dissezioni dell’arteria cervicale: fattori predisponenti, diagnosi ed esito. Lancet Neurol. 2009;8(7):668-678.
15. Giroud M, Fayolle H, Andre N, et al. Incidenza della dissezione dell’arteria carotide interna nella comunità di Digione. J Neurol Neurochirurgia Psichiatria. 1994;57(11):1443.
16. Lee VH, Brown RD, Jr., Mandrekar JN, Mokri B., Incidenza ed esito della dissezione dell’arteria cervicale: uno studio basato sulla popolazione. Neurologia. 2006;67(10):1809-1812.
17. Bejot Y, Aboa-Eboule C, Debette S, et al. Caratteristiche ed esiti di pazienti con dissezione multipla dell’arteria cervicale. Colpo. 2014;45(1):37-41.
18. Cloft HJ, Kallmes DF, Kallmes MH, Goldstein JH, Jensen ME, Dion JE. Prevalenza di aneurismi cerebrali in pazienti con displasia fibromuscolare: una rivalutazione. J Neurochirurgia. 1998;88(3):436-440.
19. Schiuma HD, Gornik HL, Olin JW, et al., Prevalenza di aneurisma intracranico nelle donne con displasia fibromuscolare: un rapporto del registro degli Stati Uniti per displasia fibromuscolare. JAMA Neurol. 2017;74(9):1081-1107.
20. Favoni V, Giani L, Al-Hassany L, et al. CGRP ed emicrania da un punto di vista cardiovascolare: cosa ci aspettiamo dal blocco del CGRP? J Mal di testa. 2019;20(1):27.
21. Schievink WI, Mokri B, O’Fallon WM. Dissezione spontanea ricorrente dell’arteria cervicale. N Ingl J Med. 1994;330(6):393-397.
22. Il suo nome deriva dal latino “Hicks C”, “Lanfranconi S”, “Hicks C”, et al., Antiaggreganti contro anticoagulanti per dissezione: braccio CADISS non randomizzato e meta-analisi. Neurologia. 2012;79(7):686-689.
23. Debette S. Fisiopatologia e fattori di rischio della dissezione dell’arteria cervicale: cosa abbiamo imparato dalle grandi coorti ospedaliere? Neurolo di Curr Opin. 2014;27(1):20-28.
24. Gli investigatori di prova CADISS, Markus HS, Hayter E, et al. Trattamento antipiastrinico rispetto al trattamento anticoagulante per la dissezione dell’arteria cervicale (CADISS): uno studio randomizzato. Lancet. Neurol 2015;14(4):361-367.
25. Il suo nome è Pen, Trattamento della dissezione dell’arteria cervicale: antitrombotici, trombolisi e terapia endovascolare. Biomed Res Int. 2017;2017:3072098.
26. Poteri WJ, Rabinstein AA, Ackerson T, et al. Linee guida per la gestione precoce dei pazienti con ictus ischemico acuto: aggiornamento 2019 alle linee guida 2018 per la gestione precoce dell’ictus ischemico acuto: una linea guida per gli operatori sanitari dell’American Heart Association/American Stroke Association. Colpo. 2019; 50 (12): e344-e418.
27. Kernan WN, Ovbiagele B, Nero HR, et al., Linee guida per la prevenzione dell’ictus nei pazienti con ictus e attacco ischemico transitorio: una linea guida per gli operatori sanitari dell’American Heart Association / American Stroke Association. Colpo. 2014;45(7):2160-2236.
28. Debette S, Metso T, Pezzini A, et al. Associazione di fattori di rischio vascolari con dissezione dell’arteria cervicale e ictus ischemico nei giovani adulti. Circolazione. 2011;123(14):1537-1544.
29. Gornik HL, Persu A, Adlam D, et al. Primo consenso internazionale sulla diagnosi e la gestione della displasia fibromuscolare. Vasc Med. 2019;24(2):164-189.,
AMS riceve il supporto di ricerca dal NIH (NINDS, NHLBI), AHA/ASA, il Coulter Translational Research Fund, e Diffusion Pharmaceuticals, Inc. Fornisco anche consulenza legale esperta in casi di neurologia vascolare.
BBW è un vice redattore per la rivista Neurology, riceve finanziamenti dal NIH (NINDS attuali,NCATS e NINDS precedenti, NHGRI) e la Commissione Fulbright australiano-americano, e non riporta alcun supporto commerciale.




