¿Cómo hago un modelo de un átomo?
¿necesitas hacer un modelo o un dibujo de un átomo para la clase de Ciencias? Si es así, siga estas instrucciones para aprender a dónde van todas las piezas del átomo.
Paso 1-reunir información
antes de que pueda construir su modelo, tendrá que saber cuántos protones, neutrones y electrones tiene su átomo. Si usted no sabe ya cómo utilizar la Tabla Periódica de elementos para encontrar esta información, lea el ‘ cuántos protones, electrones y neutrones están en un átomo de…?, página para aprender cómo.
usemos nitrógeno como ejemplo. Usando la información encontrada en la Tabla Periódica de elementos, podemos decir que un átomo promedio de nitrógeno contiene 7 protones, 7 neutrones y 7 electrones.
Paso 2-reúne materiales
Ahora que sabes cuántos protones, neutrones y electrones necesitarás para tu modelo, es hora de decidir qué usar para representarlos. Pelotas de Ping-pong, pelotas de goma, rodamientos de bolas, pelotas de golf y bolas de espuma de poliestireno se han utilizado en el pasado. Básicamente, cualquier cosa que sea redondeada y que se pueda pegar entre sí debe funcionar., Es útil si las bolas están codificadas por colores para que sea más fácil decir qué bolas son protones, cuáles son neutrones y cuáles son electrones. También es útil si los electrones son más pequeños que los protones y neutrones.
Paso 3-construir el núcleo
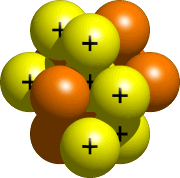
el núcleo, la parte central del átomo, está hecho de protones y neutrones. Todos los protones y neutrones de tu átomo van al núcleo. Para el nitrógeno, el núcleo sería algo como esto:
Paso 4 – Colocar los Electrones
Los electrones se encuentran fuera del núcleo., La forma de colocarlos depende de qué modelo de estructura atómica está estudiando su clase. Hay algunas maneras de hacerlo:
el modelo planetario
Este modelo representa una visión anterior de la estructura del átomo, poco después de que el núcleo fuera descubierto. Este modelo se enseña típicamente a los estudiantes más jóvenes como una introducción a la estructura atómica. En él, se dice que los electrones orbitan el núcleo al igual que los planetas en el sistema solar orbitan el sol. Dependiendo de tu profesor, las órbitas reales generalmente no importan. Tener el número correcto de electrones suele ser suficiente., Un modelo planetario de un átomo de nitrógeno podría verse algo como esto:
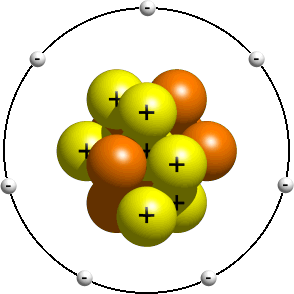
en el modelo planetario, un átomo de nitrógeno tiene un núcleo central, compuesto por siete protones y siete neutrones, rodeados por siete electrones.
el modelo de Bohr
Los científicos pronto se dieron cuenta de que el modelo planetario era una descripción inexacta de la estructura atómica. Aprendieron que los electrones solo podían ocupar ciertas órbitas (generalmente conocidas como niveles de energía o conchas) alrededor del núcleo., También descubrieron que solo un cierto número de electrones podía caber en cada nivel de energía.
para colocar correctamente los electrones alrededor del núcleo, deberá consultar la tabla de configuración electrónica de su elemento. Para encontrar la tabla de configuración electrónica de su elemento, vaya a la Tabla Periódica de elementos, haga clic en su elemento y desplácese hasta la parte inferior de la página. Si no sabe cómo leer la tabla de configuración electrónica, lea el ‘¿Cómo puedo leer una tabla de configuración electrónica? página de ayuda.,
de acuerdo con la tabla de configuración electrónica de nitrógeno, un átomo de nitrógeno contiene dos electrones en su primer nivel de energía y cinco electrones en su segundo nivel de energía. Un modelo de Bohr de un átomo de nitrógeno podría verse así:
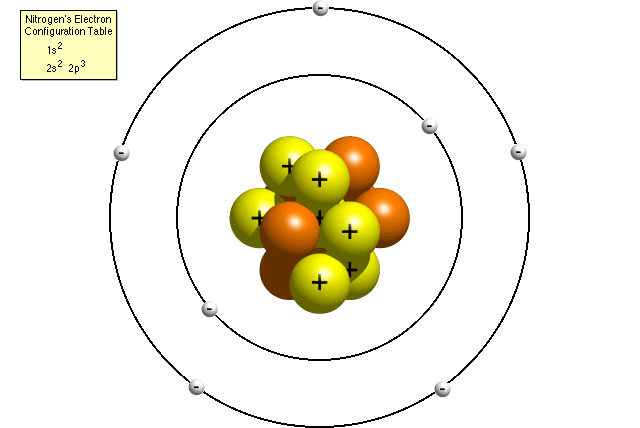
en el modelo de Bohr, un átomo de nitrógeno tiene un núcleo central, compuesto por siete protones y siete neutrones, rodeados por siete electrones. Dos de los electrones están en el primer nivel de energía, mientras que los otros cinco están en el segundo nivel de energía.,
el modelo refinado de Bohr
otros estudios mostraron que el modelo de Bohr no era tan preciso como podría ser. Los científicos aprendieron que cada nivel de energía está hecho de un cierto número de subcapas. Las subcapas, que se denominan s, p, d y f, pueden contener solo un cierto número de electrones. La subcapa s solo puede contener 2 electrones, la subcapa p Puede contener 6, la subcapa d puede contener 10 y la subcapa f puede contener 14. El número de sub-proyectiles disponibles aumenta a medida que aumenta el nivel de energía.,
para colocar correctamente los electrones alrededor del núcleo, deberá consultar la tabla de configuración electrónica de su elemento. Para encontrar la tabla de configuración electrónica de su elemento, vaya a la Tabla Periódica de elementos, haga clic en su elemento y desplácese hasta la parte inferior de la página. Si no sabe cómo leer la tabla de configuración electrónica, lea el ‘¿Cómo puedo leer una tabla de configuración electrónica? página de ayuda.,
de acuerdo con la tabla de configuración electrónica de nitrógeno, un átomo de nitrógeno contiene dos electrones en su primer nivel de energía (ambos en la subcapa s) y cinco electrones en su segundo nivel de energía (dos en la subcapa s y tres en la subcapa p). Un modelo Bohr más preciso de un átomo de nitrógeno podría verse así:
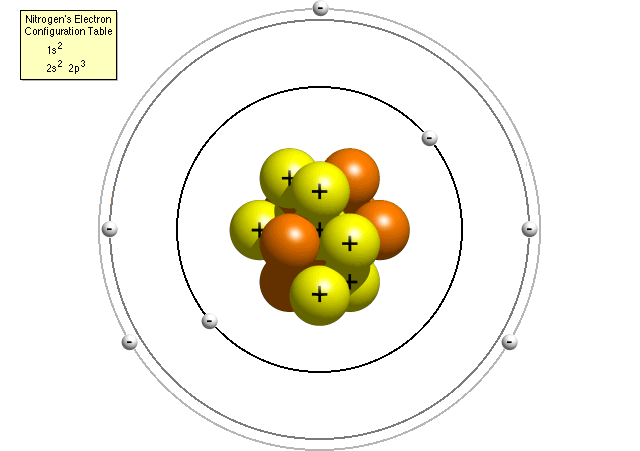
en el modelo refinado de Bohr, un átomo de nitrógeno tiene un núcleo central, compuesto de siete protones y siete neutrones, rodeado de siete electrones., Dos de los electrones están en el s sub-shell de el primer nivel de energía, dos están en la s sub-shell del segundo nivel de energía y tres se encuentran en la p sub-shell del segundo nivel de energía.
Paso 5 – Cosas para Recordar
es importante recordar que un modelo es una representación simplificada de un objeto. Algunos de los modelos discutidos anteriormente son más precisos que otros, pero ninguno de ellos es completamente correcto. Aquí hay un par de cosas que hemos ignorado:
el tamaño del núcleo
en los dibujos anteriores, el núcleo es demasiado grande., O, dicho de otra manera, si el núcleo va a ser tan grande, los electrones están demasiado cerca. Los átomos reales son en su mayoría espacio vacío. Si quisiéramos que nuestros dibujos fueran precisos, tendríamos que colocar los electrones a una milla de distancia. Claramente, sería difícil traer un dibujo tan grande a clase.
Los electrones no orbitan el núcleo
en los dibujos anteriores, hemos dibujado círculos agradables que muestran dónde van los electrones alrededor del átomo. En realidad, los científicos no pueden decir exactamente dónde está un electrón en un momento dado o hacia dónde va., Pueden calcular la probabilidad de que un electrón se encuentre en un volumen dado de espacio, pero eso no es lo mismo que saber dónde está ese electrón. Este comportamiento se describe en el modelo cuántico del átomo. Aunque es la descripción más precisa que los científicos tienen actualmente del átomo, es mucho más difícil de entender.
páginas relacionadas:
información de Citas y enlaces
para preguntas sobre esta página, comuníquese con Steve Gagnon.




