Come faccio a fare un modello di un atomo?
Hai bisogno di creare un modello o un disegno di un atomo per la classe di scienze? Se è così, segui queste istruzioni per imparare dove vanno tutti i pezzi dell’atomo.
Step 1-Raccogliere informazioni
Prima di poter costruire il vostro modello, è necessario sapere quanti protoni, neutroni ed elettroni il vostro atomo ha. Se non si sa già come utilizzare la Tavola Periodica degli elementi per trovare queste informazioni, leggere l ‘ Quanti protoni, elettroni e neutroni sono in un atomo di…?,’pagina per imparare come.
Usiamo l’azoto come esempio. Usando le informazioni trovate sulla Tavola periodica degli elementi, possiamo dire che un atomo medio di azoto contiene 7 protoni, 7 neutroni e 7 elettroni.
Step 2-Raccogliere materiali
Ora che sapete quanti protoni, neutroni ed elettroni avrete bisogno per il vostro modello, è il momento di decidere cosa usare per rappresentarli. Palline da ping-pong, palline di gomma, cuscinetti a sfera, palline da golf e palline di polistirolo sono stati tutti utilizzati in passato. Fondamentalmente, tutto ciò che è rotondo e che può essere incollato l’uno all’altro dovrebbe funzionare., È utile se le sfere sono codificate a colori in modo che sia più facile dire quali sfere sono protoni, quali sono neutroni e quali sono elettroni. È anche utile se gli elettroni sono più piccoli dei protoni e dei neutroni.
Fase 3-Costruire il nucleo
Il nucleo, la parte centrale dell’atomo, è costituito da protoni e neutroni. Tutti i protoni e i neutroni del tuo atomo vanno nel nucleo. Per l’azoto, il nucleo sarebbe simile a questo:
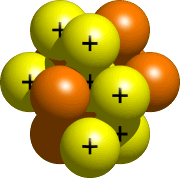
Fase 4 – Posizionare gli elettroni
Gli elettroni si trovano al di fuori del nucleo., Il modo in cui li collochi dipende da quale modello di struttura atomica sta studiando la tua classe. Ci sono alcuni modi in cui questo può essere fatto:
Il modello planetario
Questo modello descrive una visione precedente della struttura dell’atomo, poco dopo la scoperta del nucleo. Questo modello è tipicamente insegnato agli studenti più giovani come introduzione alla struttura atomica. In esso, si dice che gli elettroni orbitino attorno al nucleo proprio come i pianeti del sistema solare orbitano attorno al sole. A seconda del tuo insegnante, le orbite reali di solito non contano. Avere il giusto numero di elettroni è di solito abbastanza buono., Un modello planetario di un atomo di azoto potrebbe assomigliare a questo:
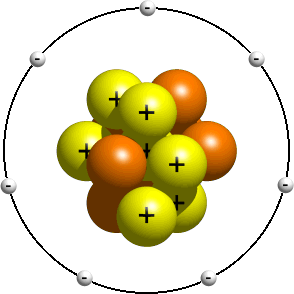
Nel modello planetario, un atomo di azoto ha un nucleo centrale, composto da sette protoni e sette neutroni, circondato da sette elettroni.
Il modello di Bohr
Gli scienziati si resero presto conto che il modello planetario era una descrizione imprecisa della struttura atomica. Hanno imparato che gli elettroni potevano occupare solo alcune orbite (di solito indicate come livelli di energia o gusci) attorno al nucleo., Hanno anche scoperto che solo un certo numero di elettroni potrebbe andare bene in ogni livello di energia.
Per posizionare correttamente gli elettroni attorno al nucleo, dovrai fare riferimento alla tabella di configurazione elettronica del tuo elemento. Per trovare la tabella di configurazione elettronica del tuo elemento, vai alla Tavola periodica degli elementi, fai clic sul tuo elemento e scorri fino alla fine della pagina. Se non sai come leggere la tabella di configurazione elettronica, leggi il ‘Come faccio a leggere una tabella di configurazione elettronica?’pagina per aiuto.,
Secondo la tabella di configurazione elettronica dell’azoto, un atomo di azoto contiene due elettroni nel suo primo livello di energia e cinque elettroni nel suo secondo livello di energia. Un modello di Bohr di un atomo di azoto potrebbe assomigliare a questo:
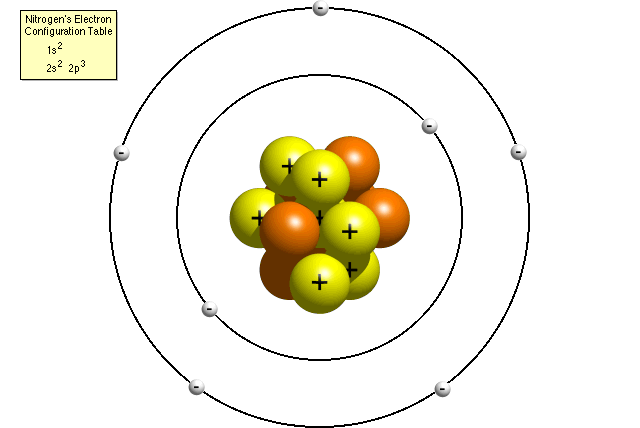
Nel modello di Bohr, un atomo di azoto ha un nucleo centrale, composto da sette protoni e sette neutroni, circondato da sette elettroni. Due degli elettroni sono nel primo livello di energia mentre gli altri cinque sono nel secondo livello di energia.,
Il raffinato modello di Bohr
Ulteriori studi hanno dimostrato che il modello di Bohr non era così preciso come potrebbe essere. Gli scienziati hanno appreso che ogni livello di energia è costituito da un certo numero di sotto-gusci. I sub-shell, che sono chiamati s, p, d e f, possono contenere solo un certo numero di elettroni. Il sub-shell s può contenere solo 2 elettroni, il sub-shell p può contenere 6, il sub-shell d può contenere 10 e il sub-shell f può contenere 14. Il numero di sottocuscini disponibili aumenta all’aumentare del livello di energia.,
Per posizionare correttamente gli elettroni attorno al nucleo, dovrai fare riferimento alla tabella di configurazione elettronica del tuo elemento. Per trovare la tabella di configurazione elettronica del tuo elemento, vai alla Tavola periodica degli elementi, fai clic sul tuo elemento e scorri fino alla fine della pagina. Se non sai come leggere la tabella di configurazione elettronica, leggi il ‘Come faccio a leggere una tabella di configurazione elettronica?’pagina per aiuto.,
Secondo la tabella di configurazione elettronica dell’azoto, un atomo di azoto contiene due elettroni nel suo primo livello di energia (entrambi nel sub-shell s) e cinque elettroni nel suo secondo livello di energia (due nel sub-shell s e tre nel sub-shell p). Un modello di Bohr più accurato di un atomo di azoto potrebbe assomigliare a questo:
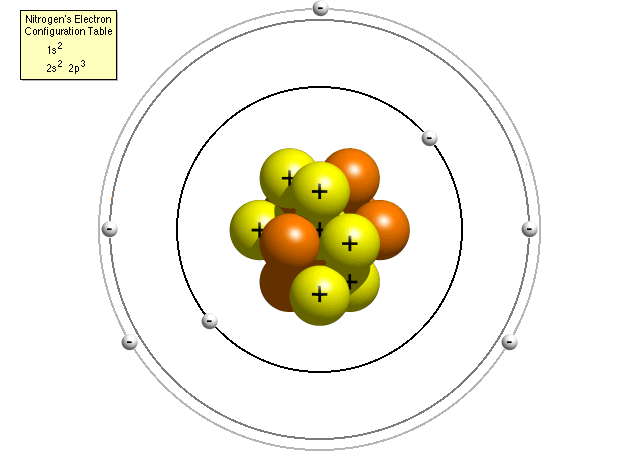
Nel raffinato modello di Bohr, un atomo di azoto ha un nucleo centrale, composto da sette protoni e sette neutroni, circondato da sette elettroni., Due degli elettroni sono nel sub-guscio s del primo livello di energia, due sono nel sub-guscio s del secondo livello di energia e tre sono nel sub-guscio p del secondo livello di energia.
Step 5-Cose da ricordare
E ‘ importante ricordare che un modello è una rappresentazione semplificata di un oggetto. Alcuni dei modelli discussi sopra sono più accurati di altri, ma nessuno di essi è completamente corretto. Ecco un paio di cose che abbiamo ignorato:
La dimensione del nucleo
Nei disegni sopra, il nucleo è troppo grande., O, in altre parole, se il nucleo sta per essere così grande, gli elettroni sono troppo vicini. Gli atomi reali sono per lo più spazio vuoto. Se volessimo che i nostri disegni fossero accurati, dovremmo posizionare gli elettroni a circa un miglio di distanza. Chiaramente, sarebbe difficile portare un disegno così grande in classe.
Gli elettroni non orbitano attorno al nucleo
Nei disegni sopra, abbiamo disegnato dei bei cerchi che mostrano dove gli elettroni girano intorno all’atomo. In realtà, gli scienziati non possono dire esattamente dove si trova un elettrone in un dato momento o dove sta andando., Possono calcolare la probabilità che un elettrone si trovi in un dato volume di spazio, ma non è la stessa cosa che sapere dove si trova quell’elettrone. Questo comportamento è descritto nel Modello quantistico dell’atomo. Sebbene sia la descrizione più accurata che gli scienziati hanno attualmente dell’atomo, è molto più difficile da capire.
Pagine correlate:
Citazione e informazioni di collegamento
Per domande su questa pagina, si prega di contattare Steve Gagnon.




