cum fac un model al unui atom?trebuie să faceți un model sau un desen al unui atom pentru clasa de știință? Dacă da, urmați aceste instrucțiuni pentru a afla unde se duc toate piesele atomului.pasul 1-Adunați informații înainte de a vă putea construi modelul, va trebui să știți câți protoni, neutroni și electroni are atomul dvs. Dacă nu știți deja cum să utilizați tabelul Periodic al elementelor pentru a găsi aceste informații, citiți ” câți protoni, electroni și neutroni sunt într-un atom de…?,”pagina pentru a afla cum.
să folosim azotul ca exemplu. Folosind informațiile găsite în tabelul Periodic al elementelor, putem spune că un atom mediu de azot conține 7 protoni, 7 neutroni și 7 electroni.acum că știți de câți protoni, neutroni și electroni veți avea nevoie pentru modelul dvs., este timpul să decideți ce să utilizați pentru a le reprezenta. Mingi de Ping-pong, bile de cauciuc, rulmenți cu bile, mingi de golf și bile de polistiren au fost folosite în trecut. Practic, orice lucru care este rotund și care poate fi lipit unul de celălalt ar trebui să funcționeze., Este util dacă bilele sunt codificate în culori, astfel încât să fie mai ușor de spus care bile sunt protoni, care sunt neutroni și care sunt electroni. De asemenea, este util dacă electronii sunt mai mici decât protonii și neutronii.Pasul 3-Construiți nucleul nucleul, partea centrală a atomului, este format din protoni și neutroni. Toți protonii și neutronii atomului tău intră în nucleu. Pentru azot, nucleul ar arăta astfel:
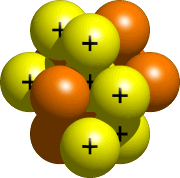
Pasul 4 – Plasați electronii
electronii se găsesc în afara nucleului., Modul în care le plasați depinde de modelul de structură atomică pe care îl studiază clasa dvs. Există câteva moduri în care se poate face acest lucru:
modelul planetar
acest model prezintă o vedere anterioară a structurii atomului, la scurt timp după descoperirea nucleului. Acest model este de obicei predat studenților mai tineri ca o introducere în structura atomică. În ea, se spune că electronii orbitează nucleul la fel ca planetele din sistemul solar care orbitează Soarele. În funcție de profesor, orbitele reale de obicei nu contează. Având numărul corect de electroni este de obicei suficient de bun., Un model planetar de un atom de azot ar putea arata ceva de genul asta:
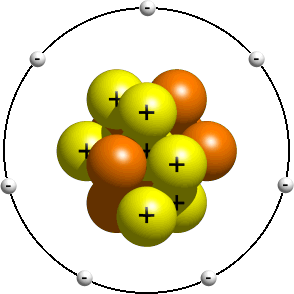
În modelul planetar, un atom de azot are un nucleu central, compus din șapte protoni și șapte neutroni, înconjurat de șapte electroni.oamenii de știință și-au dat seama curând că modelul planetar a fost o descriere inexactă a structurii atomice. Ei au aflat că electronii ar putea ocupa doar anumite orbite (denumite de obicei niveluri de energie sau cochilii) în jurul nucleului., Ei au descoperit, de asemenea, că doar un anumit număr de electroni se pot încadra în fiecare nivel de energie.pentru a plasa corect electronii în jurul nucleului, va trebui să consultați tabelul de configurare a electronilor elementului dvs. Pentru a găsi tabelul de configurare a electronilor elementului dvs., accesați tabelul Periodic al elementelor, faceți clic pe elementul dvs. și derulați în partea de jos a paginii. Dacă nu știți cum să citiți tabelul de configurare a electronilor, citiți „Cum citesc un tabel de configurare a electronilor? page pentru ajutor.,conform tabelului de configurare a electronilor azotului, un atom de azot conține doi electroni la primul nivel de energie și cinci electroni la al doilea nivel de energie. Un Bohr modelul unui atom de azot ar putea arata astfel:
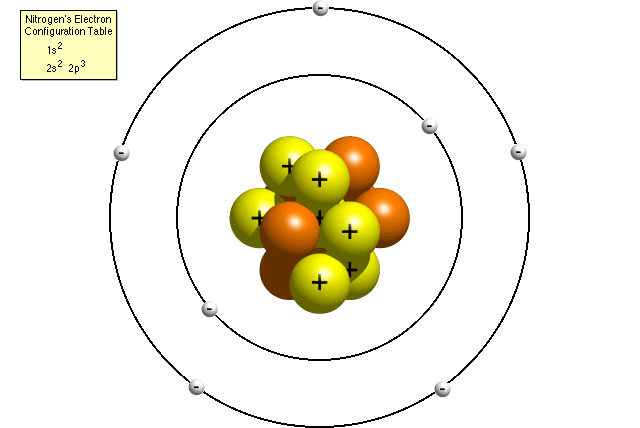
În modelul Bohr, un atom de azot are un nucleu central, compus din șapte protoni și șapte neutroni, înconjurat de șapte electroni. Doi dintre electroni se află în primul nivel de energie, în timp ce ceilalți cinci se află în al doilea nivel de energie.,studiile ulterioare au arătat că modelul Bohr nu a fost la fel de precis cum ar putea fi. Oamenii de știință au aflat că fiecare nivel de energie este realizat dintr-un anumit număr de sub-cochilii. Sub-cochilii, care sunt numiți s, p, d și f, pot fiecare să dețină doar un anumit număr de electroni. S sub-shell poate deține doar 2 electroni, p sub-shell poate deține 6, d sub-shell poate deține 10 și f sub-shell poate deține 14. Numărul de sub-cochilii disponibile crește odată cu creșterea nivelului de energie.,pentru a plasa corect electronii în jurul nucleului, va trebui să consultați tabelul de configurare a electronilor elementului dvs. Pentru a găsi tabelul de configurare a electronilor elementului dvs., accesați tabelul Periodic al elementelor, faceți clic pe elementul dvs. și derulați în partea de jos a paginii. Dacă nu știți cum să citiți tabelul de configurare a electronilor, citiți „Cum citesc un tabel de configurare a electronilor? page pentru ajutor.,conform tabelului de configurare a electronilor azotului, un atom de azot conține doi electroni în primul său nivel de energie (atât în sub-învelișul s), cât și cinci electroni în cel de-al doilea nivel de energie (doi în sub-învelișul s și trei în sub-învelișul p). O mai precisă Bohr modelul unui atom de azot ar putea arata astfel:
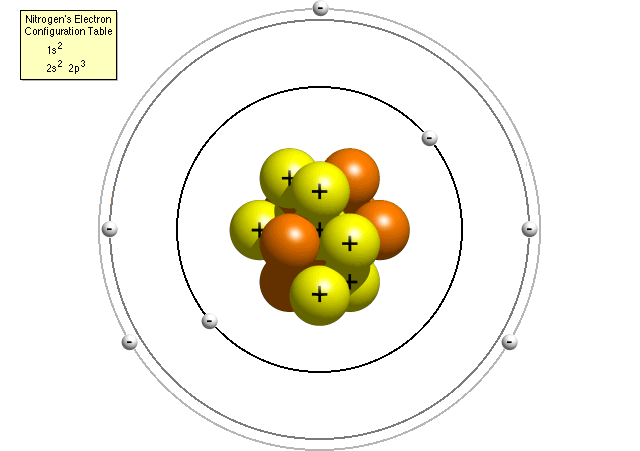
În rafinat modelul Bohr, un atom de azot are un nucleu central, compus din șapte protoni și șapte neutroni, înconjurat de șapte electroni., Doi dintre electroni se află în sub-carcasa s a primului nivel de energie, doi sunt în sub-carcasa s a celui de-al doilea nivel de energie și trei sunt în sub-carcasa p a celui de-al doilea nivel de energie.pasul 5-Lucruri de reținut este important să ne amintim că un model este o reprezentare simplificată a unui obiect. Unele dintre modelele discutate mai sus sunt mai precise decât altele, dar nici unul dintre ele nu este complet corect. Iată câteva dintre lucrurile pe care le-am ignorat:
dimensiunea nucleului
în desenele de mai sus, nucleul este prea mare., Sau, altfel spus, dacă nucleul va fi atât de mare, electronii sunt prea apropiați. Atomii reali sunt în mare parte spațiu gol. Dacă am fi vrut ca desenele noastre să fie exacte, ar fi trebuit să plasăm electronii la aproximativ o milă distanță. În mod clar, ar fi dificil să aducem un desen atât de mare la clasă.
electronii nu orbitează nucleul
în desenele de mai sus, am desenat cercuri frumoase care arată unde electronii merg în jurul atomului. În realitate, oamenii de știință nu pot spune exact unde se află un electron la un moment dat sau unde se îndreaptă., Ei pot calcula probabilitatea ca un electron să fie găsit într-un anumit volum de spațiu, dar asta nu este același lucru cu a ști unde este acel electron. Acest comportament este descris în modelul cuantic al atomului. Deși este cea mai exactă descriere pe care oamenii de știință o au în prezent despre atom, este mult mai greu de înțeles.pentru intrebari despre aceasta pagina, va rugam sa ne contactati pe Steve Gagnon.




