Comment faire un modèle d’un atome?
avez-vous besoin de faire un modèle ou un dessin d’un atome pour un cours de science? Si c’est le cas, suivez ces instructions pour savoir où vont toutes les pièces de l’atome.
Étape 1-recueillir des informations
avant de pouvoir construire votre modèle, vous aurez besoin de savoir combien de protons, de neutrons et d’électrons votre atome A. Si vous ne savez pas déjà comment utiliser le tableau périodique des éléments pour trouver cette information, lisez le » Combien de protons, électrons et neutrons sont dans un atome de…?,’page pour savoir comment.
nous allons utiliser l’azote comme un exemple. En utilisant les informations trouvées sur le tableau périodique des éléments, nous pouvons dire qu’un atome moyen d’azote contient 7 protons, 7 neutrons et 7 électrons.
Étape 2 – rassembler des matériaux
maintenant que vous savez combien de protons, de neutrons et d’électrons vous aurez besoin pour votre modèle, il est temps de décider quoi utiliser pour les représenter. Les balles de Ping-pong, les balles en caoutchouc, les roulements à billes, les balles de golf et les balles en polystyrène ont toutes été utilisées dans le passé. Fondamentalement, tout ce qui est rond et qui peut être collé les uns aux autres devrait fonctionner., Il est utile si les boules sont codées par couleur afin qu’il soit plus facile de dire quelles boules sont des protons, qui sont des neutrons et qui sont des électrons. Il est également utile si les électrons sont plus petits que les protons et les neutrons.
Etape 3 – Construire le Noyau
Le noyau, la partie centrale de l’atome, est composé de protons et de neutrons. Tous les protons et neutrons de votre atome vont dans le noyau. Pour l’azote, le noyau devrait ressembler à quelque chose comme ceci:
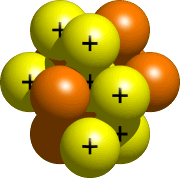
Étape 4 – Placer les Électrons
Les électrons se trouvent à l’extérieur du noyau., La façon dont vous les placez dépend du modèle de structure atomique que votre classe étudie. Il y a plusieurs façons de le faire:
le modèle planétaire
Ce modèle représente une vue antérieure de la structure de l’atome, peu de temps après la découverte du noyau. Ce modèle est généralement enseigné aux jeunes étudiants comme une introduction à la structure atomique. On y dit que les électrons orbitent autour du noyau un peu comme les planètes du système solaire orbitent autour du soleil. Selon votre professeur, les orbites réelles n’ont généralement pas d’importance. Avoir le bon nombre d’électrons est généralement suffisant., Un modèle planétaire de l’atome d’azote pourrait ressembler à quelque chose comme ceci:
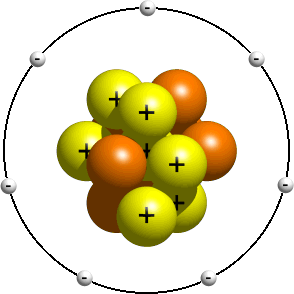
Dans le modèle planétaire, un atome d’azote possède un noyau central, composé de sept protons et les sept neutrons, entouré par sept électrons.
le modèle de Bohr
Les scientifiques ont vite compris que le modèle planétaire était une description inexacte de la structure atomique. Ils ont appris que les électrons ne pouvaient occuper que certaines orbites (généralement appelées niveaux d’énergie ou coquilles) autour du noyau., Ils ont également découvert que seul un certain nombre d’électrons pouvait tenir dans chaque niveau d’énergie.
pour placer correctement les électrons autour du noyau, vous devrez vous référer à la table de configuration des électrons de votre élément. Pour trouver le tableau de configuration électronique de votre élément, allez dans le tableau périodique des éléments, cliquez sur votre élément et faites défiler vers le bas de la page. Si vous ne savez pas lire la table de configuration des électrons, lisez la section » Comment lire une table de configuration des électrons?’pour obtenir de l’aide.,
selon le tableau de configuration électronique de l’azote, un atome d’azote contient deux électrons dans son premier niveau d’énergie et cinq électrons dans son deuxième niveau d’énergie. Un modèle de Bohr de l’atome d’azote pourrait ressembler à ceci:
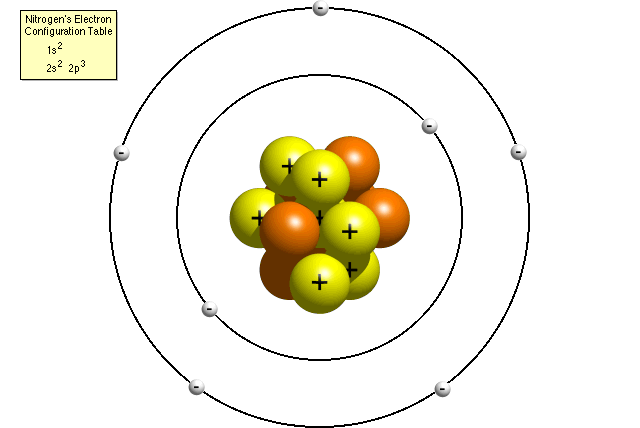
Dans le modèle de Bohr, un atome d’azote possède un noyau central, composé de sept protons et les sept neutrons, entouré par sept électrons. Deux électrons sont dans le premier niveau d’énergie tandis que les cinq autres sont dans le second niveau d’énergie.,
Le Raffinée Modèle de Bohr
d’Autres études ont montré que le modèle de Bohr n’était pas aussi précis qu’il pourrait l’être. Les scientifiques ont appris que chaque niveau d’énergie est fabriqué à partir d’un certain nombre de sous-coquilles. Les sous-coques, nommées s, p, d et f, ne peuvent chacune contenir qu’un certain nombre d’électrons. La sous-coque s ne peut contenir que 2 électrons, la sous-coque p peut contenir 6, la sous-coque d peut contenir 10 et la sous-coque f peut contenir 14. Le nombre de sous-obus disponibles augmente à mesure que le niveau d’énergie augmente.,
pour placer correctement les électrons autour du noyau, vous devrez vous référer à la table de configuration des électrons de votre élément. Pour trouver le tableau de configuration électronique de votre élément, allez dans le tableau périodique des éléments, cliquez sur votre élément et faites défiler vers le bas de la page. Si vous ne savez pas lire la table de configuration des électrons, lisez la section » Comment lire une table de configuration des électrons?’pour obtenir de l’aide.,
selon le tableau de configuration électronique de l’azote, un atome d’azote contient deux électrons dans son premier niveau d’énergie (les deux dans la sous-coquille s) et cinq électrons dans son deuxième niveau d’énergie (deux dans la sous-coquille s et trois dans la sous-coquille p). Un modèle Bohr plus précis d’un atome d’azote pourrait ressembler à ceci:
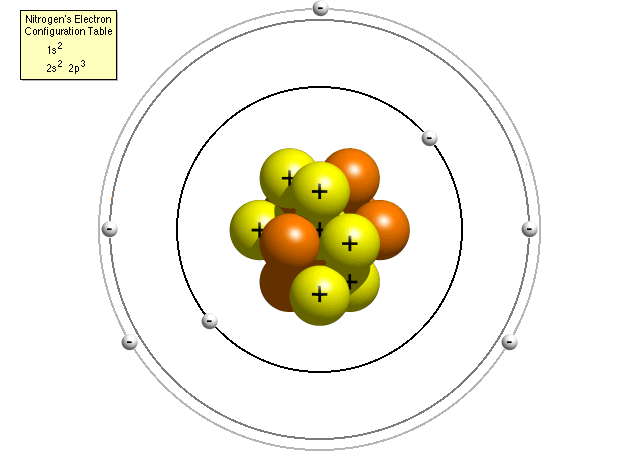
dans le modèle Bohr raffiné, un atome d’azote a un noyau central, composé de sept protons et de sept neutrons, entouré de sept électrons., Deux électrons sont dans le sous-shell du premier niveau d’énergie, les deux sont dans le sous-shell du deuxième niveau d’énergie, et les trois sont dans la p la sous-enveloppe de la deuxième niveau d’énergie.
Etape 5 – les Choses à retenir
Il est important de rappeler qu’un modèle est une représentation simplifiée d’un objet. Certains des modèles discutés ci-dessus sont plus précis que d’autres, mais aucun d’entre eux n’est complètement correct. Voici quelques-unes des choses que nous avons ignorées:
La Taille du noyau
dans les dessins ci-dessus, le noyau est trop grand., Ou, en d’autres termes, si le noyau va être aussi grand, les électrons sont trop proches. Les atomes réels sont pour la plupart un espace vide. Si nous voulions que nos dessins soient précis, nous devrions placer les électrons à environ un mile de distance. De toute évidence, il serait difficile d’apporter un dessin aussi grand en classe.
Les électrons N’orbitent pas autour du noyau
dans les dessins ci-dessus, nous avons dessiné de jolis cercles montrant où les électrons vont autour de l’atome. En réalité, les scientifiques ne peuvent pas dire exactement où se trouve un électron à un moment donné ni où il va., Ils peuvent calculer la probabilité qu’un électron soit trouvé dans un volume d’espace donné, mais ce n’est pas la même chose que de savoir où se trouve cet électron. Ce comportement est décrit dans le Modèle Quantique de l’atome. Bien que ce soit la description la plus précise que les scientifiques ont actuellement de l’atome, elle est beaucoup plus difficile à comprendre.
Pages connexes:
Citation et liens
pour toute question concernant cette page, veuillez communiquer avec Steve Gagnon.




