¿cuáles son las concentraciones ambientales de O2 y CO2?
modo lector
todos sabemos que el aire que respiramos está compuesto por un 20% de oxígeno. La concentración de dióxido de carbono ha superado recientemente los niveles de 400 partes por millón, los más altos en millones de años, bombeados por las actividades humanas. Estos gases atmosféricos son críticos para los estilos de vida de plantas y animales por igual. Sin embargo, las reacciones biológicas tienen lugar en medios líquidos y, por lo tanto, deben depender de la solubilidad de estos componentes inorgánicos clave., ¿Qué concentraciones de oxígeno y dióxido de carbono ven las células en su vida cotidiana en los medios acuosos dentro de los cuales viven?
los organismos vivos se construyen a partir de cuatro tipos principales de átomos: carbono, oxígeno, nitrógeno e hidrógeno. En el cuerpo humano, juntos ascienden a ≈96% del peso húmedo y ≈87% del peso seco como se muestra en la viñeta «¿Cuál es la composición elemental de una célula?”. Sin embargo, el conjunto de estos constituyentes en el medio celular es a menudo de suministro limitado. Por ejemplo, como discutiremos a continuación, el oxígeno es soluble en agua a solo alrededor de 10 partes por millón., En el caso del carbono y el nitrógeno, estos átomos están atados en una forma inorgánica relativamente inerte secuestrada en CO2 y N2, respectivamente. Como resultado, las células deben encontrar formas de extraer estas moléculas de estos reservorios inaccesibles y convertirlas en alguna forma utilizable. Aunque «agua» y «aire» son conocidos por todos de la misma manera que cualquier persona que vive en climas septentrionales tiene una respuesta visceral a la palabra «nieve», a menudo se olvida que estas palabras de la lengua vernácula común enmascaran una rica realidad molecular.,
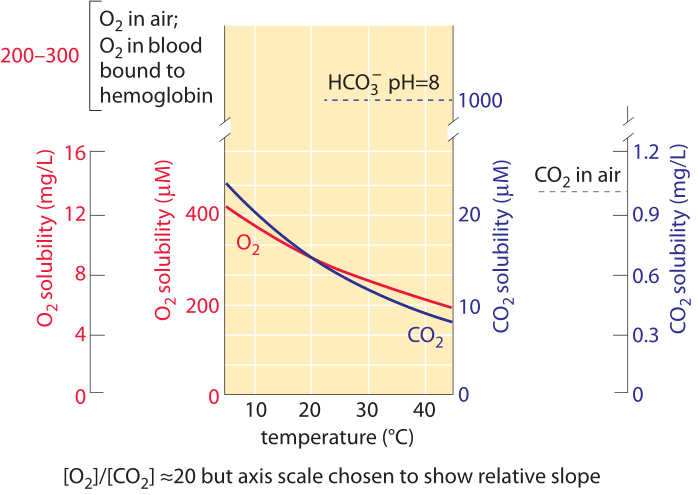
Figura 1: la solubilidad de oxígeno y dióxido de carbono en agua y su dependencia de la temperatura bajo composición normal del aire. Los valores del eje y para los dos gases se eligieron para permitir la comparación del cambio con la temperatura, pero tenga en cuenta que la escala de concentración de oxígeno es 10 veces mayor. La concentración de oxígeno en el aire es aproximadamente 500 veces mayor que el CO2, pero el oxígeno es aproximadamente 50 veces menos soluble. Para ambos gases la concentración es menor a temperaturas más altas., A medida que aumenta la temperatura, la disponibilidad de CO2 disminuye más rápido que la del oxígeno. El bicarbonato (HCO3 -) es la forma inorgánica de carbono más abundante en el rango de pH 6-10. El oxígeno en la sangre se transporta principalmente unido a la hemoglobina a una concentración similar a la del oxígeno en el aire. Esta concentración es cerca de 50 veces más alta que sería llevada por el líquido de la sangre sin hemoglobina. La parcela se refiere al Agua Dulce; la solubilidad es aproximadamente 20-30% menor en el agua salada del Océano. Datos en las curvas calculadas por los autores en base a la Ley de Henry.,
El carbono entra en la Biosfera cuando se transforma de su forma oxidada en CO2 a una forma reducida principalmente en el motivo repetitivo de carbohidratos (CHOH)n. este motivo constituye los azúcares en general, y es el componente principal de las paredes celulares presentes tanto en los microbios como en las plantas que componen la mayor parte de la materia orgánica en la Biosfera. Esta transformación se produce en un proceso conocido como fijación de carbono realizado por plantas, algas y una serie de bacterias conocidas como autótrofos., La concentración de CO2 disuelto en agua en equilibrio con la atmósfera es ≈10 µM (BNID 108697) como se muestra en la Figura 1. Esto significa que solo hay alrededor de 104 moléculas de CO2 en un volumen de agua del tamaño de una bacteria. Esto debe compararse con los 1010 átomos de carbono que se requieren para constituir una bacteria. La concentración de O2 es igualmente bastante baja en ≈100-300 µM (BNID 109182 y ver Figura 1 para apreciar cómo esta solubilidad cambia con la temperatura). La solubilidad del oxígeno en el agua es aproximadamente 50 veces menor que la del CO2., Como resultado, a pesar de que el oxígeno en el aire es aproximadamente 500 veces más abundante que el CO2, la relación de concentración entre O2 y CO2 en solución es de aproximadamente 10 en lugar de 500. Por definición, cada mg/L en la Figura 1 es una parte por millón en términos de masa, por lo que la rareza de oxígeno y dióxido de carbono se puede apreciar directamente observando que la concentración de estos gases se encuentra en el dominio de un solo dígito en términos de mg / L y, por lo tanto, solo muy pocas partes por millón. El CO2 tiene la característica añadida de que reacciona con el agua para dar, a valores de pH fisiológicamente relevantes, principalmente bicarbonato (HCO3–)., A pH 7 hay aproximadamente 10 veces más carbono inorgánico en forma de bicarbonato que el CO2 disuelto. A pH 8, característico del agua del océano, hay 100 veces más bicarbonato que CO2 disuelto. Estas piscinas son de importancia para cualquiera que tenga como objetivo medir las piscinas de carbono inorgánico disponibles para las células. Específicamente, el Censo de estos reservorios moleculares es importante para entender el secuestro de carbono en los océanos o el transporte de carbono inorgánico en nuestra sangre desde los tejidos hasta los pulmones., La transición del CO2 al bicarbonato y viceversa se ve reforzada por la acción de la anhidrasa carbónica. Esta transición permite a la célula reponer la pequeña piscina rápidamente agotada de CO2 de la piscina mucho más grande de carbono inorgánico en forma de bicarbonato.
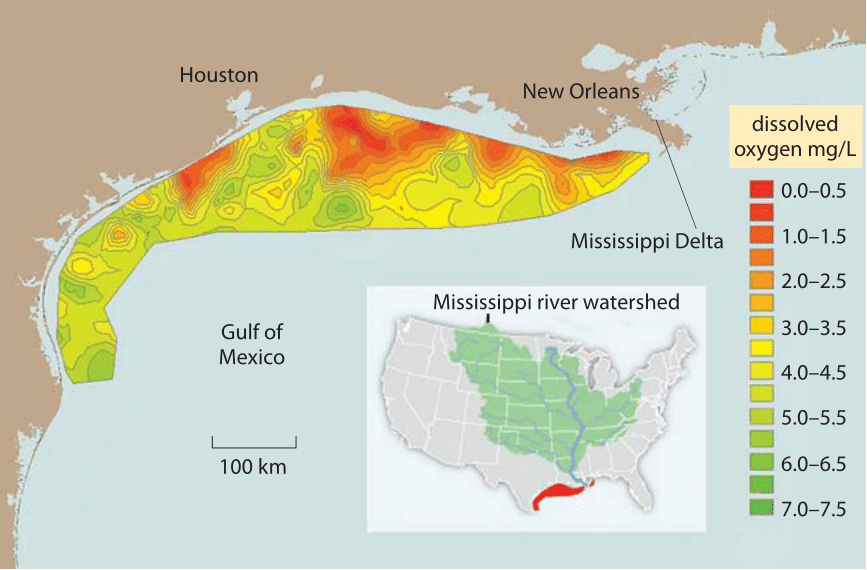
Figura 2: zona Muerta en el Golfo de México, debido a los fertilizantes agrícolas sufragados por el Río Mississippi., El promedio a largo plazo para el área de hipoxia en el fondo del verano (Color Rojo), donde los niveles de oxígeno disuelto <2 mg/L (también conocida como zona muerta, donde el agotamiento del oxígeno conduce a la asfixia de los peces) es de 13,000 km cuadrados, alrededor del área de Connecticut. Los valores indican el oxígeno medido en las estaciones de fondo marino. Normal, cerca de la saturación completa con (oxígeno se traduce en concentraciones de aproximadamente 7-9 mg / L como se muestra en la Figura 1. 1 mg / L es aproximadamente 1 parte por millón. Los valores para otras partes del Golfo de México no se muestran porque no hay estaciones de medición ubicadas allí., (Figura adaptada de NOAA. http://service.ncddc.noaa.gov/rdn/www/media/hypoxia/maps/2011-hypoxia-contours.jpg http://www.ncddc.noaa.gov/hypoxia/products/ http://si.wsj.net/public/resources/images/NA-AZ768A_DEADZ_NS_20090817185740.jpg http://toxics.usgs.gov/hypoxia/hypoxic_zone.html)
En muchos entornos acuosos la baja solubilidad y la lenta difusión de O2 es una limitación importante para el metabolismo aeróbico de los organismos. Por ejemplo, consideremos el problema ambiental agudo de la eutrofización, el proceso por el cual el oxígeno se agota cuando se lavan cantidades excesivas de fertilizantes que contienen nitrógeno y fósforo a una cuenca de agua previamente limitada por nutrientes, lo que conduce a floraciones de plancton., Cuando el plancton se hunde posteriormente, su biomasa es respirada por bacterias que consumen oxígeno en el proceso. El suministro limitado de oxígeno se traduce en enormes zonas muertas en el Golfo de México, algunas tan grandes como el área ocupada por el estado de Connecticut como se muestra en la Figura 2. Mientras que la concentración de oxígeno puede ser limitante para la respiración en algunos organismos, para aquellos que realizan la fijación de carbono en realidad puede ser demasiado alta. Como se observa en la Figura 1, la solubilidad depende de la temperatura, de modo que a temperaturas más altas hay relativamente menos CO2 con respecto al O2., Esto se sugiere para impulsar la presión selectiva que conduce a las plantas de C4 (por ejemplo, maíz y caña de azúcar), que emplean bombas metabólicas para aumentar localmente las concentraciones de CO2 para la fijación de carbono.
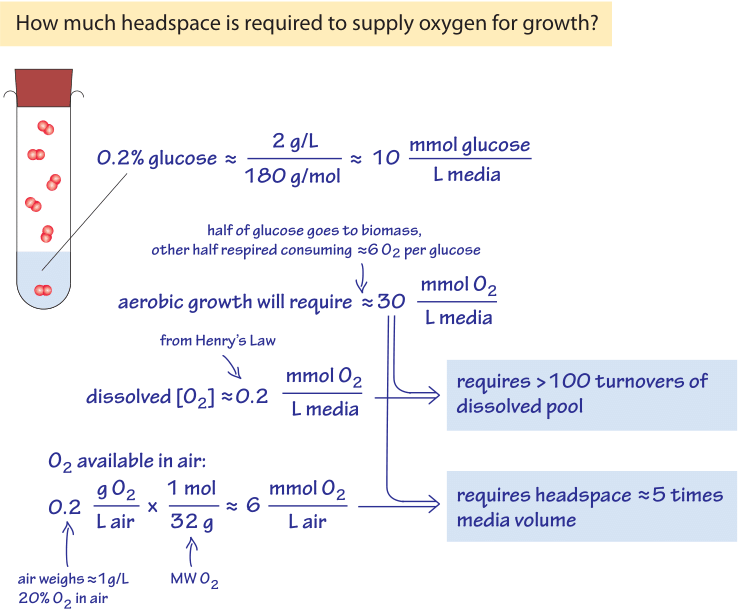
Figura 3: parte posterior del cálculo de la envolvente sobre la disponibilidad de oxígeno para el crecimiento en medios líquidos & el espacio de cabeza de la cámara de crecimiento lleno de aire.
para ilustrar el significado de las bajas concentraciones de oxígeno encontradas en ambientes marinos en un contexto de laboratorio familiar, piense en un cultivo nocturno de bacterias., Las células crecen de un pequeño número de células a la saturación en un OD600 de aproximadamente 1 (correspondiente a aproximadamente 100-1000 millones de células bacterianas por mL como se discute en la viñeta sobre «¿cuál es la concentración de células bacterianas en un cultivo saturado?»), en condiciones que pueden describirse en gran medida como aeróbicas. El crecimiento es facilitado por un azúcar como la glucosa en los medios (digamos 0.2% en masa, equivalente a ≈10mM). En la Figura 3 se muestra esquemáticamente un cálculo sencillo de las necesidades de oxígeno de dicho crecimiento., Como un escenario de referencia razonable, considere que aproximadamente la mitad de este azúcar se utilizará para la construcción de biomasa y la otra mitad para hacer energía (como se evidencia en la observación de que el rendimiento de carbono almacenado como biomasa del carbono tomado de los medios de crecimiento es generalmente ≈0.5, BNID 105318). La estequiometría del proceso de respiración es tal que para cada molécula de glucosa, se utilizan 6 moléculas de O2. Por lo tanto, en un sistema cerrado, 5 mM de glucosa respirada para hacer energía requerirán aproximadamente 30 mM de oxígeno., La concentración de oxígeno se observó anteriormente en los cientos de µM, que es aproximadamente 100 veces menor. Por lo tanto, podemos concluir, como se calcula en la Figura 3, que se necesitarán más de 100 ciclos de reabastecimiento (pérdidas de volumen) de la piscina de oxígeno disuelto en los medios de crecimiento para satisfacer las necesidades de respiración de la glucosa. La reposición se logra generalmente por agitación vigorosa, burbujeo o impulsores especiales. El medio de crecimiento está rodeado por aire que tiene una fracción de oxígeno del 20% equivalente a aproximadamente 10 µmol por litro (de aire)., Como se analiza en la Figura 3, un espacio de cabeza de unas pocas veces el volumen de cultivo contiene suficiente oxígeno para el crecimiento del cultivo, siempre que la aireación sea lo suficientemente vigorosa como para disolver el oxígeno del espacio de cabeza en el medio líquido. Como una forma alternativa de pensar sobre esta estimación, considere la regla general de que la conversión de glucosa en biomasa bacteriana requiere aproximadamente 1 g de O2 por 1 g de peso seco celular producido (la mayoría de él emitido al respirar como CO2)., Un OD600 de 1 tiene aproximadamente 1 g de peso seco celular por litro que requerirá 1 g de oxígeno, o 30 mmol, de acuerdo con la derivación anterior.
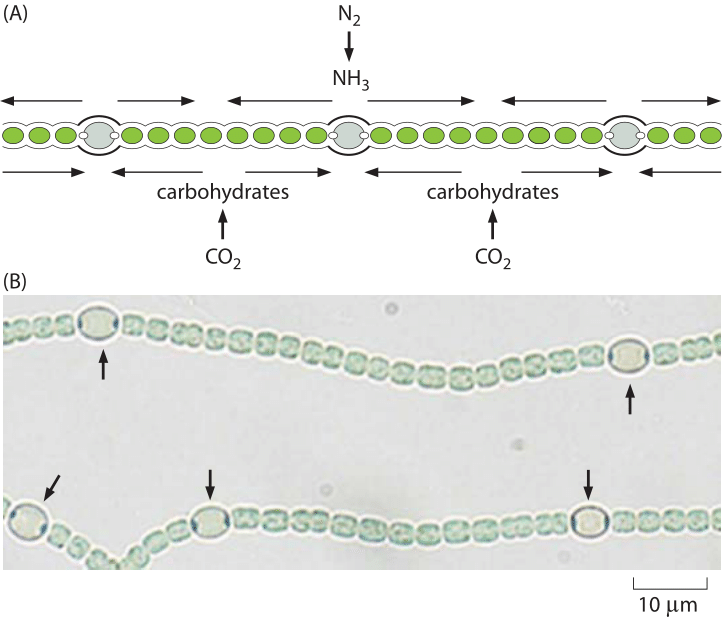
Figura 4: Heterocistos en Anabaena. A) esquema que muestra la posición regular de los heterocistos en Anabaena que convierten el dinitrógeno en amoníaco. B) imágenes microscópicas que muestran tanto células vegetativas como heterocistos (marcadas con flechas). (Adaptado de Physical Biology of the Cell, 2nd Edition., Garland Science, 2012)
El oxígeno no es el único componente celular crítico que tiene un suministro limitado. El nitrógeno, que comprende alrededor del 80% de la atmósfera de la Tierra, es altamente inerte, ya que está casi exclusivamente atado en forma de N2. Este nitrógeno llegó a la atmósfera a través de la acción de bacterias que utilizan nitrógeno como aceptor de electrones en un proceso conocido como desnitrificación (otro ejemplo de cómo la biología ayuda a dar forma a la tierra). Para que el nitrógeno atmosférico vuelva a estar disponible para la bioquímica, es necesario un proceso desafiante, i. e., convertir nitrógeno en amonio (NH4+), nitratos (NO3–) o nitritos (NO2–). Los organismos capaces de realizar este proceso de fijación de nitrógeno son organismos unicelulares como los socios simbióticos microbianos que se encuentran en las raíces de las legumbres. Solo una enzima es capaz de llevar a cabo este proceso, a saber, la nitrogenasa. La nitrogenasa es sensible al oxígeno, por lo que requiere un ambiente local desprovisto de oxígeno, hecho que lleva a algunos sistemas microbianos a desarrollar células especializadas conocidas como heterocistos, como se muestra en la Figura 4, que son el sitio de estas transacciones de nitrógeno., A escala global, el ciclo natural de fijación de nitrógeno es aumentado por la humanidad a través de una cantidad comparable de nitrógeno reducido alcanzado en el proceso industrial Haber-Bosch que resulta en fertilizantes que son esenciales para alimentar a una gran parte de la humanidad, pero que también resultan en la eutrofización ecológica mencionada anteriormente. El hecho de que los seres humanos están haciendo cambios en los principales ciclos biogeoquímicos que involucran las piscinas de estas sustancias inorgánicas clave nos alerta para pensar en lo que es efectivamente un experimento gigante dirigido por humanos dedicado a alterar la Biosfera.,









