The chemical element rubidium is classed as an alkali metal. It was discovered in 1861 by Robert Bunsen and Gustav Kirchhoff.

Data Zone
| Classification: | Rubidium is an alkali metal |
| Color: | silvery-white |
| Atomic weight: | 85.,468 |
| State: | solid |
| Melting point: | 39.3 oC, 312.45 K |
| Boiling point: | 690 oC, 963 K |
| Electrons: | 37 |
| Protons: | 37 |
| Neutrons in most abundant isotope: | 48 |
| Electron shells: | 2,8,18,8,1 |
| Electron configuration: | 5s1 |
| Density @ 20oC: | 1.,53 g/cm3 |
Show more, including: Heats, Energies, Oxidation,
Reactions, Compounds, Radii, Conductivities
| Atomic volume: | 55.9 cm3/mol |
| Structure: | bcc: body-centered cubic |
| Hardness: | 0.3 mohs |
| Specific heat capacity | 0.363 J g-1 K-1 |
| Heat of fusion | 2.192 kJ mol-1 |
| Heat of atomization | 81 kJ mol-1 |
| Heat of vaporization | 72.,216 kJ mol-1 |
| 1st ionization energy | 403 kJ mol-1 |
| 2nd ionization energy | 2632.1 kJ mol-1 |
| 3rd ionization energy | 3859.4 kJ mol-1 |
| Electron affinity | 46.885 kJ mol-1 |
| Minimum oxidation number | 0 |
| Min. common oxidation no. | 0 |
| Maximum oxidation number | 1 |
| Max. common oxidation no. | 1 |
| Electronegativity (Pauling Scale) | 0.,82 |
| Polarizabilidad de volumen | 47.,O, Rb2O2, Rb2O3, RbO2 (brown rubidium superoxide) |
| Hydride(s) | RbH |
| Chloride(s) | RbCl |
| Atomic radius | 248 pm |
| Ionic radius (1+ ion) | 166 pm |
| Ionic radius (2+ ion) | – |
| Ionic radius (3+ ion) | – |
| Ionic radius (1- ion) | – |
| Ionic radius (2- ion) | – |
| Ionic radius (3- ion) | – |
| Thermal conductivity | 58.,2 W m-1 K-1 |
| conductividad Eléctrica | 47.8 x 106 S m-1 |
| Congelación/punto de Fusión: | 39.3 oC, 312.45 K |

Rubidio en un tubo de vidrio. Imagen de Dennis S. K (1).
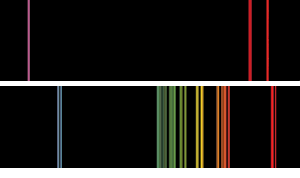
espectros básicos de emisión de llama del tipo que Bunsen y Kirchoff podrían haber visto. El espectro superior es el potasio, con la línea violeta distintiva., En el caso del rubidio, las líneas gemelas de color rojo rubí más adentro de la parte roja del espectro que Bunsen y Kirchoff habían visto antes indicaban la presencia de un nuevo elemento.
descubrimiento de rubidio
el rubidio fue descubierto en 1861, en Heidelberg, Alemania, por Robert Bunsen y Gustav Kirchhoff usando espectroscopia, el método que la pareja había inventado y desarrollado en los dos años anteriores.,
en el corazón del espectroscopio yacía un prisma de vidrio, que divide la luz proveniente de una llama en un espectro, de la misma manera que las gotas de lluvia pueden dividir la luz solar en un arco iris. El espectroscopio magnificó el espectro para permitir que se estudiara en detalle.
Cuando Bunsen y Kirchhoff colocaron diferentes sales en la llama del recién inventado quemador Bunsen, vieron líneas de colores en cada uno de los espectros que tomaron.
excitantemente, descubrieron que estas líneas de colores eran únicas para cualquier sustancia quemada., Las líneas en un espectro eran una forma de’ huella digital ‘ de un elemento.
Bunsen y Kirchoff habían descubierto el cesio en 1860 cuando analizaron el espectro del agua mineral.
en 1861 comenzaron a estudiar el mineral lepidolita (un silicato de litio, potasio y aluminio) que se había encontrado en Sajonia, Alemania. (2)
Bunsen y Kirchoff utilizaron ácido clorhídrico para precipitar el cloroplatinato de potasio del mineral. En el cloroplatinato de potasio encontraron otra sal. (2,3)
colocando esta sal en el quemador Bunsen, vieron que su espectro contenía muchas líneas nuevas., Dos de estas líneas fueron particularmente sobresalientes.
en sus notas Bunsen y Kirchoff escribieron: «ninguna de las líneas pertenece a ningún cuerpo previamente conocido. Entre ellos hay dos que son particularmente notables por estar más allá de la línea de Fraunhofer en la porción más externa del espectro solar rojo. Por lo tanto, proponemos para este nuevo metal el nombre rubidium (y el símbolo Rb) del latín rubidius que se usó para expresar el color rojo más oscuro.»(3)
Bunsen fue capaz de extraer rubidio metálico de su sal de cloruro por electrólisis., Descubrió que el metal era más electropositivo que el potasio y que el agua descompuesta liberaba hidrógeno. (4)
la concentración de rubidio en la lepidolita había sido tan pequeña que Bunsen y Kirchoff necesitaron procesar 150 kilogramos (330 lb) del mineral para extraer suficiente metal para estudiar sus propiedades. (2)
el rubidio se comporta como un metal típico del Grupo 1. Es suave y reacciona violentamente con el agua. El rubidio sigue al potasio en el Grupo 1, por lo que sus reacciones son más violentas que las del potasio. el rubidio se vuelve líquido a 39,3 oC (102.,7 oF) – a little higher than your body temperature.
| Group 1 | Group 2 | Group 3 | |
| 4 | 19 K |
20 Ca |
21 Sc |
| 5 | 37 Rb |
38 Sr |
39 Y |
| 6 | 55 Cs |
56 Ba |
57 La |

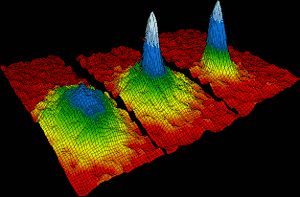
los átomos de rubidio se unieron en 1995 para formar el primer condensado de Bose-Einstein. Dentro de las 170 mil millonésimas de un grado de cero absoluto, aproximadamente dos mil átomos individuales de rubidio se unieron para formar un solo átomo gigante, que se comportó como una sola especie. La imagen de la izquierda muestra la situación antes de que se formara el condensado. A la derecha, los colores blanco y azul muestran la alta densidad del átomo gigante., Eric Cornell, Carl Wieman y Wolfgang Ketterle ganaron el Premio Nobel de Física en 2001 por sus logros en la fabricación de condensados de Bose Einstein.
Apariencia y Características
los efectos Nocivos:
Rubidio no se sabe que es tóxico.
Características:
El rubidio es un elemento metálico suave, blanco plateado. Es sólido a temperatura ambiente pero se funde fácilmente, a 39.3 oC.,
al igual que los otros metales del Grupo 1, el rubidio reacciona violentamente con el agua, formando hidróxido de rubidio corrosivo (RbOH) y gas hidrógeno, que se enciende por el calor de la reacción.
el rubidio también puede inflamarse espontáneamente en el aire. Forma aleaciones con cesio, oro, sodio y potasio y forma amalgamas con mercurio.
el rubidio arde con un color de llama rojizo-violeta.
usos del rubidio
el rubidio se utiliza en fotocélulas, como captador (eliminador de gases traza) en tubos de vacío y como fluido de trabajo en turbinas de vapor.,
el rubidio-87 es ligeramente radiactivo y se ha utilizado ampliamente en la datación de rocas.
Los compuestos de rubidio dan un color púrpura en los fuegos artificiales.
Las sales de rubidio se utilizan en vidrios y cerámicas.
abundancia e isótopos
abundancia corteza terrestre: 90 partes por millón en peso, 21 partes por millón en moles
abundancia sistema solar: 30 partes por billón en peso, 0.4 partes por billón en moles
costo, puro: 1 1200 por 100g
costo, a granel:or 100g
Fuente: el mineral principal de rubidio lepidolita que contiene 1,5% de rubidio., El rubidio se obtiene generalmente como subproducto de la producción de litio. El rubidio metálico también se puede producir reduciendo el cloruro de rubidio con calcio.
isótopos: el rubidio tiene 29 isótopos cuyas vidas medias se conocen, con números de masa de 74 a 102. El rubidio natural es una mezcla de dos isótopos, 85Rb y 87Rb con abundancias naturales de 72.2% y 27.8% respectivamente.,

Citar esta Página
Para la vinculación en línea, por favor copie y pegue uno de los siguientes:
<a href="https://www.chemicool.com/elements/rubidium.html">Rubidium</a>
o
<a href="https://www.chemicool.com/elements/rubidium.html">Rubidium Element Facts</a>
Para citar esta página en un documento académico, por favor, utilice el siguiente MLA compatible cita:
"Rubidium." Chemicool Periodic Table. Chemicool.com. 18 Oct. 2012. Web. <https://www.chemicool.com/elements/rubidium.html>.




