
Sapunuri sunt agenți de curățare, care sunt de obicei realizate prin reacția metalelor alcaline (de exemplu, hidroxid de sodiu) cu care apar în mod natural de grăsimi și acizi grași. Reacția produce săruri de sodiu ale acestor acizi grași, care îmbunătățesc procesul de curățare, făcând apa mai capabilă să ridice petele grase de pe piele, păr, haine și aproape orice altceva., Ca substanță care a ajutat la curățarea corpurilor, precum și a bunurilor, săpunul a fost remarcabil de util.
istoria săpunului
descoperirea săpunului precede istoria înregistrată, revenind probabil până la șase mii de ani. Săpăturile din Babilonul antic descoperit cilindri cu inscripții pentru a face săpun în jurul valorii de 2800 B. C. E. mai Târziu înregistrări din Egiptul antic (c. 1500 B. C. E. ) descrie cum uleiuri animale și vegetale au fost combinate cu săruri alcaline pentru a face săpun. conform legendei romane, săpunul și-a luat numele de pe Muntele Sapo, unde animalele au fost sacrificate., Ploaia ar spăla grăsimea de la animalele sacrificate împreună cu cenușa alcalină din lemn din focurile sacrificiale în râul Tiber, unde oamenii au găsit amestecul care a ajutat la curățarea hainelor. Această rețetă pentru fabricarea săpunului a fost relativ neschimbată timp de secole, coloniștii americani colectând și gătind seu de animale (grăsime topită) și apoi amestecându-l cu o soluție de potasiu alcalină obținută din cenușa de lemn de esență tare acumulată din incendiile lor de iarnă. În mod similar, europenii au făcut ceva cunoscut sub numele de săpun castilic folosind ulei de măsline., Numai de la mijlocul secolului al XIX-lea procesul a devenit comercializat și săpunul a devenit disponibil pe scară largă pe piața locală. structura de bază a tuturor săpunurilor este în esență aceeași, constând dintr-o „coadă” lungă de hidrocarburi hidrofobe (temătoare de apă) și un „cap” anionic hidrofil (care se îndepărtează de apă):
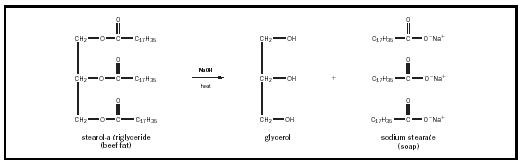
CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 lanțul de hidrocarburi („n”) variază în funcție de tipul de grăsime sau ulei, dar este de obicei destul de lung., Încărcarea anionică pe capul carboxilat este de obicei echilibrată fie de un cation de potasiu (K + ) încărcat pozitiv, fie de sodiu (Na+). În fabricarea săpunului, trigliceridele din grăsimi sau uleiuri sunt încălzite în prezența unei baze alcaline puternice, cum ar fi hidroxidul de sodiu, producând trei molecule de săpun pentru fiecare moleculă de glicerol. Acest proces se numește saponificare și este ilustrat în Figura 1. la fel ca detergenții sintetici, săpunurile sunt substanțe „active de suprafață” (surfactanți ) și, ca atare, îmbunătățesc apa la curățarea suprafețelor., Apa, deși un solvent general bun, este, din păcate, și o substanță cu o tensiune superficială foarte mare. Din această cauză, moleculele de apă preferă în general să rămână împreună decât să ude alte suprafețe. Surfactanții funcționează prin reducerea tensiunii superficiale a apei, permițând moleculelor de apă să ude mai bine suprafața și astfel să crească capacitatea apei de a dizolva petele murdare și uleioase.
în studierea modului în care funcționează săpunul, este util să luăm în considerare o regulă generală a naturii: „cum se dizolvă ca.,”Cozile nepolare hidrofobe de săpun sunt lipofile („iubitoare de ulei”) și astfel se vor încorpora în grăsime și uleiuri care ajută murdăria și petele să adere la suprafețe. Capetele hidrofile, totuși, rămân înconjurate de moleculele de apă la care sunt atrase. Pe măsură ce tot mai multe molecule de săpun se încorporează într-o pată grasă, în cele din urmă înconjoară și izolează particule mici de grăsime și formează structuri numite micele care sunt ridicate în soluție., Într-o micelă, cozile moleculelor de săpun sunt orientate spre și în grăsime, în timp ce capetele se îndreaptă spre exterior în apă, rezultând o emulsie de particule de grăsime cu săpun suspendate în apă. cu agitare, micelele sunt dispersate în apă și îndepărtate de pe suprafața murdară anterior. În esență, moleculele de săpun dizolvă parțial pata grasă pentru a forma emulsia care este ținută suspendată în apă până când poate fi clătită (vezi Figura 2). la fel de bune ca săpunurile, ele nu sunt perfecte., De exemplu, ele nu funcționează bine în apa tare care conține ioni de calciu și magneziu, deoarece sărurile de calciu și magneziu ale săpunului sunt insolubile; ele tind să se lege de ionii de calciu și magneziu, în cele din urmă precipitând și căzând din soluție. În acest sens, săpunurile murdăresc de fapt suprafețele pe care au fost proiectate să le curețe. Astfel, săpunurile au fost în mare parte înlocuite în soluțiile moderne de curățare cu detergenți sintetici care au o grupare sulfonat (R-SO 3 − ) în locul capului carboxilat (R-COO − )., Detergenții sulfonați tind să nu precipite cu ioni de calciu sau magneziu și sunt, în general, mai solubili în apă. deși popularitatea săpunului a scăzut din cauza detergenților superiori, una dintre utilizările majore ale seu de animale este încă pentru fabricarea săpunului, la fel cum a fost în anii trecuți. Dincolo de capacitatea sa de curățare, săpunul a fost utilizat în alte aplicații. De exemplu, anumite săpunuri pot fi amestecate cu benzină pentru a produce napalm gelatinos, o substanță care arde mai lent decât benzina pură atunci când este aprinsă sau explodată în război., Săpunurile sunt, de asemenea, utilizate în „căldură conservată”, un amestec comercializat de săpun și alcool care poate fi aprins și folosit pentru a găti alimente sau pentru a oferi căldură. În general, săpunul este o substanță remarcabil de utilă, la fel cum a fost de mii de ani.




