The chemical element rubidium is classed as an alkali metal. It was discovered in 1861 by Robert Bunsen and Gustav Kirchhoff.

Data Zone
| Classification: | Rubidium is an alkali metal |
| Color: | silvery-white |
| Atomic weight: | 85.,468 |
| State: | solid |
| Melting point: | 39.3 oC, 312.45 K |
| Boiling point: | 690 oC, 963 K |
| Electrons: | 37 |
| Protons: | 37 |
| Neutrons in most abundant isotope: | 48 |
| Electron shells: | 2,8,18,8,1 |
| Electron configuration: | 5s1 |
| Density @ 20oC: | 1.,53 g/cm3 |
Show more, including: Heats, Energies, Oxidation,
Reactions, Compounds, Radii, Conductivities
| Atomic volume: | 55.9 cm3/mol |
| Structure: | bcc: body-centered cubic |
| Hardness: | 0.3 mohs |
| Specific heat capacity | 0.363 J g-1 K-1 |
| Heat of fusion | 2.192 kJ mol-1 |
| Heat of atomization | 81 kJ mol-1 |
| Heat of vaporization | 72.,216 kJ mol-1 |
| 1st ionization energy | 403 kJ mol-1 |
| 2nd ionization energy | 2632.1 kJ mol-1 |
| 3rd ionization energy | 3859.4 kJ mol-1 |
| Electron affinity | 46.885 kJ mol-1 |
| Minimum oxidation number | 0 |
| Min. common oxidation no. | 0 |
| Maximum oxidation number | 1 |
| Max. common oxidation no. | 1 |
| Electronegativity (Pauling Scale) | 0.,82 |
| volum Polarizabilitate | 47.,O, Rb2O2, Rb2O3, RbO2 (brown rubidium superoxide) |
| Hydride(s) | RbH |
| Chloride(s) | RbCl |
| Atomic radius | 248 pm |
| Ionic radius (1+ ion) | 166 pm |
| Ionic radius (2+ ion) | – |
| Ionic radius (3+ ion) | – |
| Ionic radius (1- ion) | – |
| Ionic radius (2- ion) | – |
| Ionic radius (3- ion) | – |
| Thermal conductivity | 58.,2 W m-1 K-1 |
| conductivitate Electrică | 47.8 x 106 S m-1 |
| Congelare/punctul de Topire: | 39.3 oC, 312.45 K |

Rubidiu într-un tub de sticlă. Imagine de Dennis S. K (1).
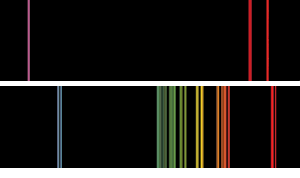
de Bază flacără spectrele de emisie de genul asta Bunsen și a lui kirchhoff poate fi văzut. Spectrul superior este potasiul, cu linia violetă distinctivă., În cazul rubidiului, liniile roșii rubinice gemene mai îndepărtate în partea roșie a spectrului decât au văzut vreodată Bunsen și Kirchoff au indicat prezența unui element nou.
Descoperirea de Rubidiu
Rubidiu a fost descoperit în 1861, în Heidelberg, Germania, de către Robert Bunsen și Gustav Kirchhoff folosind spectroscopia, metoda perechea a inventat și dezvoltat în ultimii doi ani.,
La inima spectroscop pune-o prismă de sticlă, care a împărțit lumina care vine de la o flacără într-un spectru mult în același mod în care picăturile de ploaie pot împărți lumina într-un curcubeu. Spectroscopul a mărit spectrul pentru a-i permite să fie studiat în detaliu.când Bunsen și Kirchhoff au plasat diferite săruri în flacăra arzătorului Bunsen recent inventat, au văzut linii colorate în fiecare dintre spectrele pe care le-au luat. în mod emoționant, au descoperit că aceste linii colorate erau unice pentru orice substanță a fost arsă., Liniile dintr-un spectru erau o modalitate de „amprentare” a unui element. Bunsen și Kirchoff au descoperit cesiul în 1860 când au analizat spectrul apei minerale.în 1861 au început să studieze lepidolitul mineral (un silicat de litiu, potasiu și aluminiu) care a fost găsit în Saxonia, Germania. (2)
Bunsen și Kirchoff au utilizat acid hidrocloroplatanic pentru precipitarea cloroplatinatului de potasiu din mineral. În cloroplatinat de potasiu au găsit o altă sare. (2,3)
plasând această sare în arzătorul Bunsen, au văzut că spectrul său conținea multe linii noi., Două dintre aceste linii au fost deosebit de remarcabile.în notele lor Bunsen și Kirchoff au scris: „niciuna dintre linii nu aparține vreunui corp cunoscut anterior. Printre acestea sunt două care sunt deosebit de remarcabile în situată dincolo de linia lui Fraunhofer în porțiunea cea mai exterioară a spectrului solar roșu. Prin urmare, propunem pentru acest nou metal numele rubidium (și simbolul Rb) din latinescul rubidius care a fost folosit pentru a exprima cea mai întunecată culoare roșie. Bunsen a reușit să extragă metalul de rubidiu din sarea sa de clorură prin electroliză., El a descoperit că metalul era mai electropozitiv decât potasiul și apa descompusă eliberând hidrogen. Concentrația de rubidiu din lepidolit a fost atât de mică încât Bunsen și Kirchoff au trebuit să proceseze 150 kg (330 lb) de minereu pentru a extrage suficient metal pentru a-i studia proprietățile. (2)
Rubidium ‘ s Periodic Table Neighborhood
Rubidium se comportă ca un grup tipic 1 metal. Este moale și reacționează violent cu apa. Rubidiul urmează potasiul în Grupa 1, deci reacțiile sale sunt mai violente decât potasiul. rubidiul devine lichid la 39,3 oC (102.,7 oF) – a little higher than your body temperature.
| Group 1 | Group 2 | Group 3 | |
| 4 | 19 K |
20 Ca |
21 Sc |
| 5 | 37 Rb |
38 Sr |
39 Y |
| 6 | 55 Cs |
56 Ba |
57 La |

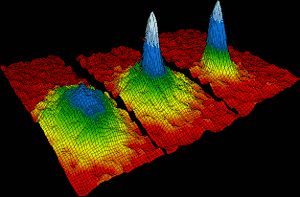
atomi de Rubidiu venit împreună în 1995 pentru a forma prima condensat Bose-Einstein. În termen de 170 de miliarde de un grad de zero absolut, aproximativ două mii de atomi individuali de rubidiu s-au reunit pentru a forma un singur atom gigant, care s-a comportat ca o singură specie. Imaginea din stânga arată situația înainte de formarea condensului. În dreapta, culorile alb și albastru arată densitatea mare a atomului gigant., Eric Cornell, Carl Wieman și Wolfgang Ketterle au câștigat Premiul Nobel pentru Fizică în 2001 pentru realizările lor în realizarea Condensatelor Bose Einstein.
aspect și caracteristici
efecte dăunătoare:
rubidiul nu este cunoscut ca fiind toxic.
caracteristici:
rubidiul este un element metalic moale, alb-argintiu. Este solid la temperatura camerei, dar se topește ușor, la 39,3 oC.,ca și celelalte metale din grupa 1, rubidiul reacționează violent cu apa, formând hidroxid de rubidiu coroziv (RbOH) și gaz de hidrogen, care este aprins de căldura reacției.rubidiul se poate aprinde, de asemenea, spontan în aer. Formează aliaje cu cesiu, aur, sodiu și potasiu și formează amalgame cu mercur.rubidiul arde cu o culoare de flacără roșiatică-violetă.rubidiul este utilizat în fotocelule, ca getter (remover de gaze urme) în tuburi de vid și ca fluid de lucru în turbine cu vapori.,rubidiu-87 este ușor radioactiv și a fost utilizat pe scară largă în datare roci.compușii de rubidiu dau o culoare purpurie în focuri de artificii.sărurile de rubidiu sunt utilizate în pahare și ceramică.
Abundență și Izotopi
Abundență în scoarța pământului: 90 de părți per milion de greutate, 21 de părți per milion de alunite
Abundenta sistemul solar: 30 părți pe miliard de greutate, de 0,4 părți pe miliard de alunite
Cost, pură: 1200 dolari per 100g
Cost, vrac: $ per 100g
Sursa: Principalul minereu de rubidiu este lepidolite care conține 1,5% rubidiu., Rubidiul este de obicei obținut ca produs de producție de litiu. Metalul rubidiu poate fi produs și prin reducerea clorurii de rubidiu cu calciu.
izotopi: rubidiul are 29 de izotopi ale căror timpi de înjumătățire sunt cunoscuți, cu numere de masă de la 74 la 102. Rubidiul natural este un amestec de doi izotopi, 85Rb și 87Rb cu abundențe naturale de 72,2% și, respectiv, 27,8%.,

Cite această Pagină
Pentru on-line de legătură, vă rugăm să copiați și inserați codul în una din următoarele:
<a href="https://www.chemicool.com/elements/rubidium.html">Rubidium</a>
sau
<a href="https://www.chemicool.com/elements/rubidium.html">Rubidium Element Facts</a>
Pentru a cita această pagină într-un mediu academic document, vă rugăm să folosiți următoarele MLA conforme citare:
"Rubidium." Chemicool Periodic Table. Chemicool.com. 18 Oct. 2012. Web. <https://www.chemicool.com/elements/rubidium.html>.




