în chimie, moleculele cu un aranjament necoliniar al două legături adiacente au geometrie moleculară îndoită. Anumiți atomi, cum ar fi oxigenul, își vor stabili aproape întotdeauna cele două (sau mai multe) legături covalente în direcții necoliniare datorită configurației lor de electroni. Apa (H2O) este un exemplu de moleculă îndoită, precum și analogii acesteia. Unghiul de legătură dintre cei doi atomi de hidrogen este de aproximativ 104,45°., Geometria neliniară este frecvent observată pentru alte molecule triatomice și ioni care conțin numai elemente din grupa principală, exemple proeminente fiind dioxidul de azot (NO2), diclorura de sulf (SCl2) și metilenul (CH2).,
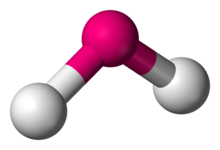
H2O, SO2
C2v
90°<θ<120°
>0

difluorura de Oxigen, un exemplu de molecule cu îndoit geometrie de coordinare.,această geometrie este aproape întotdeauna în concordanță cu teoria VSEPR, care explică de obicei non-colinearitatea atomilor cu prezența perechilor singure. Există mai multe variante de îndoire, unde cea mai comună este AX2E2, unde două legături covalente și două perechi singulare ale atomului central (A) formează o coajă completă de 8 electroni. Ele au unghiuri centrale de la 104° la 109,5°, unde acesta din urmă este în concordanță cu o teorie simplistă care prezice simetria tetraedrică a patru orbite hibridizate sp3., Cele mai comune unghiuri reale sunt 105°, 107° și 109°: ele variază datorită proprietăților diferite ale atomilor periferici (X).alte cazuri prezintă, de asemenea, hibridizare orbitală, dar în grade diferite. Moleculele AX2E1, cum ar fi SnCl2, au o singură pereche și unghiul central de aproximativ 120° (centrul și două vârfuri ale unui triunghi echilateral). Au trei orbite sp2. Există, de asemenea, compuși ax2 hibridizați sd ai metalelor de tranziție fără perechi singulare: au unghiul central de aproximativ 90° și sunt, de asemenea, clasificați ca fiind îndoiți.




