Conjugarea În Chimia Organică: Definiție, Exemple, Explorare, și Consecințele
Acesta este primul dintr-o serie de posturi care în cele din urmă va acoperi conjugare, pi sisteme, molecular orbital teorie, dienes, 1,2 și 1,4 – completări, Diels-Alder reacție și alte pericyclic reacții. Vom începe prin revizuirea elementelor de bază!,Dezvăluit De „al Doilea cel Mai bun” de Rezonanță de Formă
Revizuirea Pi Bond (și Pi lipire): „-Pe Partea de” Orbital Suprapunere Între Adiacente p-Orbitali
Unul dintre primele lucruri pe care le înveți despre alchene este că rotația despre C-C pi (π), bond nu are loc., De exemplu, la temperaturi și presiuni normale., trans-2-butena (prezentată mai jos stânga) nu se observă niciodată că se transformă spontan în cis-2-butenă (dreapta) . Sunt compuși separabili, cu diferite puncte de topire și fierbere. Puteți cumpăra fiecare dintre ele separat de Aldrich. Acest lucru nu ar fi posibil dacă ar exista o rotație liberă cu privire la legătura dublă.,săpând mai adânc în acest lucru, am văzut că acest lucru se datorează unui fenomen numit „lipire pi” – o suprapunere laterală a doi orbitali p adiacenți, fiecare conținând un electron, ceea ce duce la o orientare preferată în care p-orbitalii „se aliniază” unul lângă celălalt, ca soldații. Datorită geometriei de tip gantera a p-orbitalului, suprapunerea nu este posibilă atunci când cele două p-orbitale sunt la 90° unul față de celălalt, ceea ce reprezintă acea „barieră de rotație”.,
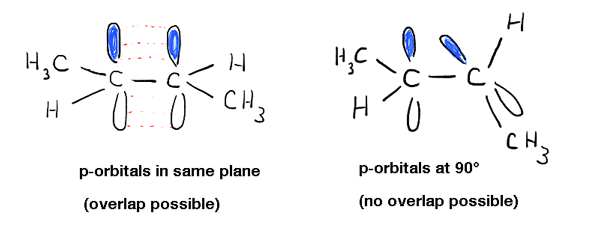
aceasta are și alte consecințe fizice în afară de bariera de rotație: influențează și geometria moleculară. Deoarece legarea Pi este un fenomen exclusiv p-orbitalilor, asta înseamnă că fiecare legătură pi la care participă un atom va lăsa un p-orbital mai puțin disponibil pentru” hibridizare ” cu orbitalul s pe atom. Aceasta are ca rezultat geometria familiară „trigonal planar” (sp2 ) pentru carbonii alchenici tipici și geometria „liniară” (sp) pentru carbonii alchinici.prin urmare, alchenele sunt „plate”, spre deosebire de carbonii alchil, care adoptă o geometrie tetraedrică.,
importanța suprapunerii orbitale pentru legarea Pi
o ilustrare vie a importanței suprapunerii orbitale este prezentată de un caz în care am putea crede naiv că o dublă legătură „ar trebui” să se formeze – dar nu. Bredt observate în 1924 că alchene nu au tendința de a forma pe „cap de pod” poziții, cum ar fi în moleculă la stânga jos, o observație care a ajuns să fie numit „Bredt e regula”.
de ce nu? Dacă faceți modelul, veți vedea că geometria inelului biciclic forțează acei orbitali p să fie orientați în unghi drept. Nu există nici o suprapunere între orbitalii P., Prin urmare, seamănă cu un carbon cu doi radicali adiacenți mai mult decât o legătură reală pi!
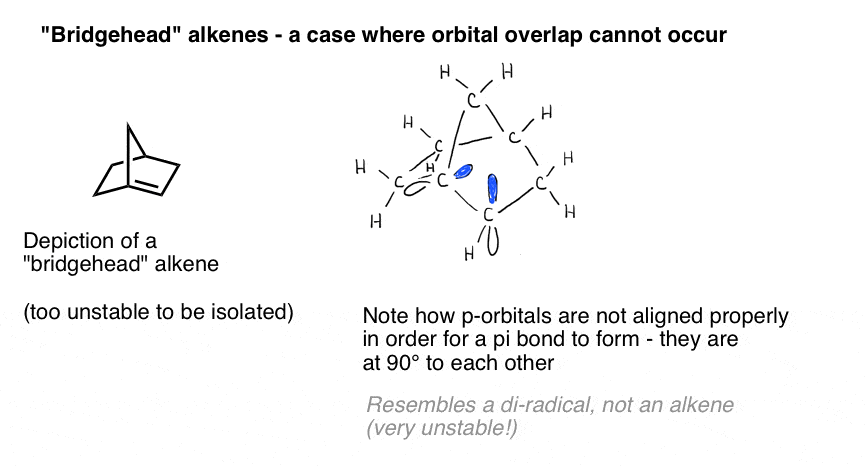
desenele tridimensionale pe o suprafață plană nu fac cu adevărat dreptate gloriei structurii 3-dimensionale. Iată un model și un videoclip însoțitor. aceste lucruri roz ar trebui să fie p-orbitalii. Vezi cum sunt în unghi drept unul față de celălalt? Asta înseamnă că nu se suprapun.linia de jos este că aveți nevoie de suprapunere între orbitalii p pentru ca o legătură Pi să se formeze., În sistemele aciclice, care nu este, în general, o problemă
3. Dincolo de legăturile Pi:” conjugarea ” a 3 sau mai mulți orbitali p
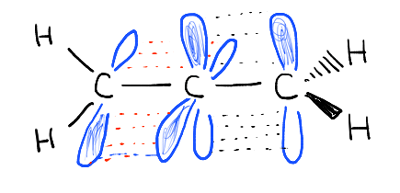
în chimia organică din primul semestru aflăm că această suprapunere a orbitalilor p nu se limitează neapărat la două orbitali p adiacenți. Suprapunerea se poate extinde dincolo de doi orbitali p pentru a include trei, patru, cinci și chiar mai mulți orbitali p consecutivi pe atomi consecutivi, construind „sisteme pi” mai mari (licopenul martor, de exemplu).,de asemenea, vedem că definiția „orbitalului p” este oarecum flexibilă și poate include exemple precum
pe care o numim „construirea” orbitalilor p în „sisteme pi” mai mari, „conjugare”. În fiecare dintre moleculele medii de mai jos, alchena (legătura pi) este conjugată cu un orbital p adiacent.
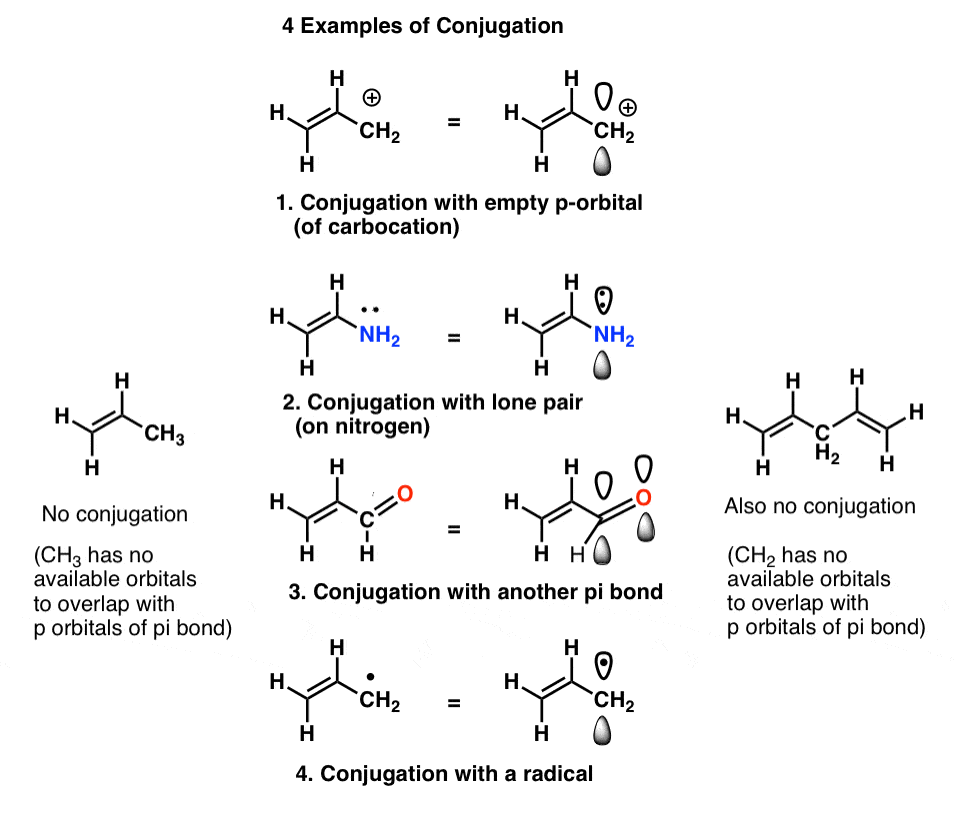
„conjugare criminal” pentru a viziona afară pentru este un atom lipsit singuratic perechi conectat la numai singur obligațiuni, cum ar fi CH2 în exemplul de mai jos-dreapta (1,4-pentadiene). Aceste două legături pi nu sunt conjugate.
Iată o întrebare truc distractiv., Sunt legăturile duble din molecula de mai jos (alenă) conjugate? De ce sau de ce nu?
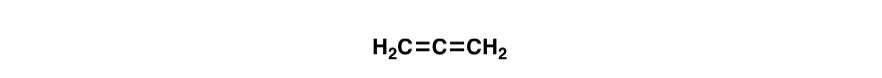
4. Distincția dintre conjugare și rezonanță
s-ar putea să vă întrebați: sună doar ca rezonanță. Care-i diferența?să luăm o secundă pentru a distinge conjugarea și rezonanța.
- conjugarea este ceea ce o numim atunci când 3 sau mai multe orbitale p se unesc într-un „sistem pi”mai mare.,
- aceste sisteme pi conjugate conțin electroni, pe care îi numim adesea „electroni pi” pentru a le distinge de electronii care cuprind legături unice în moleculă.
- diferitele aranjamente ale electronilor din acel „sistem pi” se numesc forme de rezonanță.,
O analogie dur ar putea merge ca aceasta:
- Cred că de orbitalii p ca fiind un pic ca „camere” pentru electroni (capacitatea maximă: 2)
- participarea la mai multe camere într-o clădire mai mare este conjugare
- diferite admisibile aranjamente de oameni (electroni) în clădire sunt forme de rezonanță. cerința cheie pentru conjugare este suprapunerea orbitală, pe care o vom extinde într-un pic.pentru moment, să trecem în revistă câteva consecințe ale conjugării.,
Consecințele de Conjugare (1): Lungimile de Legătură
după Cum am spus, suntem mai mult folosit pentru conjugarea în contextul de „rezonanță”, un concept pe care ne-am acoperit înainte (și din această serie este de a merge în al doilea semestru teritoriu, este în valoare de re-familiarizarea cu)
De exemplu, cu acetat de ion (CH3CO2)– și cation alilic (ambele prezentate mai jos), am văzut că există două moduri diferite de aranjare a pi electroni, pe care o numim „forme de rezonanță”.,
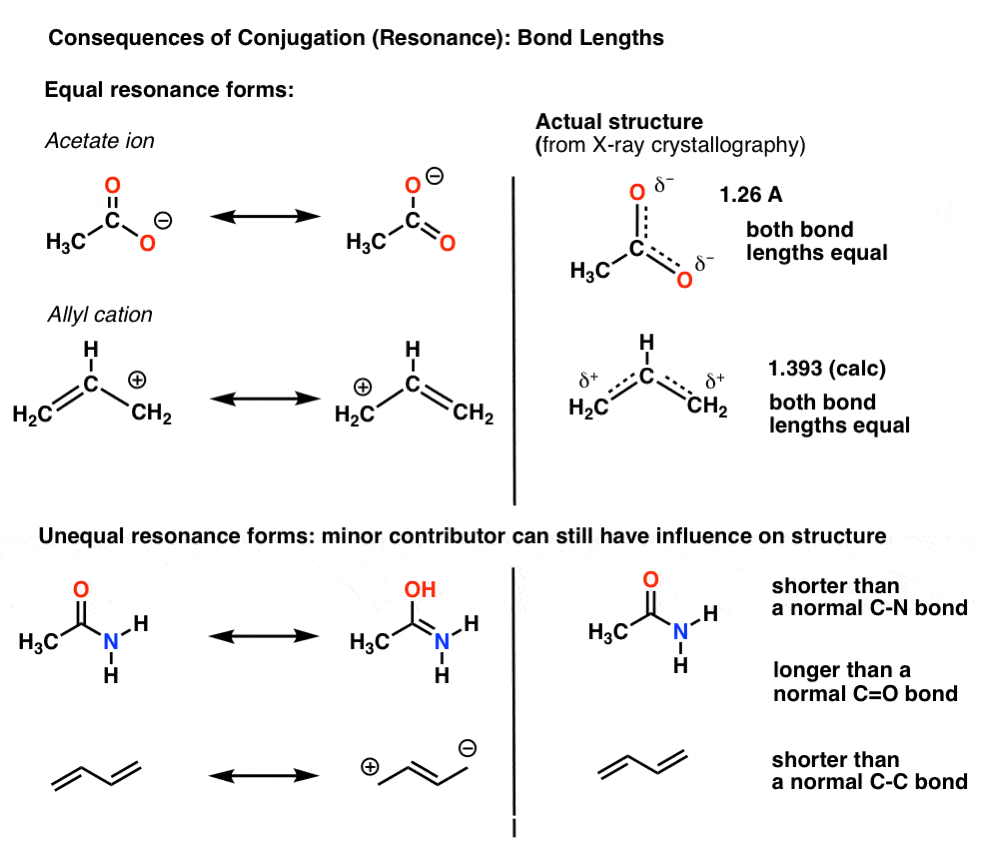
punctul important de reținut este că electronii pi din acestea nu comută constant înainte și înapoi între atomi; mai degrabă, structura” adevărată ” a moleculei este un hibrid al acestor forme de rezonanță.o consecință importantă a rezonanței este lungimile legăturilor care sunt intermediare între două forme., când formele de rezonanță nu sunt identice, hibridul de rezonanță va fi un hibrid „ponderat” dintre cele mai importante forme de rezonanță
în ionul acetat și cationul de alil cele două forme de rezonanță importante sunt echivalente, astfel încât ambele ajung să contribuie în mod egal la hibrid.
o situație mai frecventă se găsește molecule precum cele de mai jos există un amestec de forme de rezonanță inegale. Unele forme de rezonanță sunt mai importante decât altele. .,limbajul nostru vizual al chimiei, cu distincția sa clară între legăturile simple și duble, nu descrie cu exactitate densitatea electronilor din molecule, care sunt un hibrid ponderat de forme de rezonanță. Contribuitorii minori de rezonanță influențează lungimile legăturii din moleculă, făcându-le mai scurte sau mai lungi decât în mod normal.
în molecula de sus (butadienă), acea legătură centrală C-C este puțin mai scurtă decât o legătură unică C-C „normală” (adică are un pic de caracter de legătură dublă) datorită influenței contributorului minor de rezonanță la hibrid.,
în molecula de jos („acetamidă”) legătura C-O este puțin mai lungă decât o legătură C=O „normală” (adică are mai mult caracter de legătură unică), iar legătura C-N este puțin mai scurtă decât o legătură c-n „normală” (adică are mai mult caracter de legătură dublă). Aceasta reflectă influența” contributorului minor „(sau a contributorului” al doilea cel mai bun”, dacă doriți) în care există o legătură c-n pi și o legătură unică C-O.
să facem primul nostru salt conceptual.
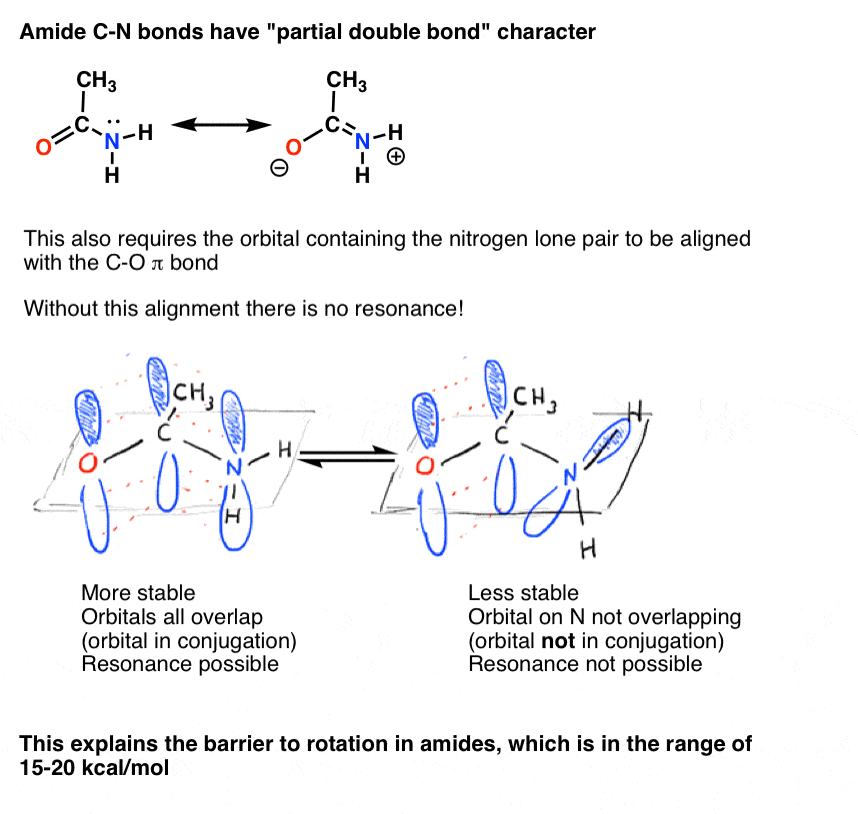
7., Consecințele conjugării (2): legături duble „parțiale”
există o consecință interesantă a acelui „caracter de legătură dublă parțială” în legătura C-N. Are o ” barieră în calea rotației „la fel cum ne-am aștepta de la o”legătură dublă”! Bariera de rotație în legătura C-N A amidelor este de aproximativ 15-20 kcal/mol în legăturile peptidice (comparați cu aproximativ 2-3 kcal/mol pentru majoritatea legăturilor C-C).ceea ce înseamnă acest lucru este că cele două conformații pot încă să se interconvertească, dar o fac relativ lent la temperatura camerei., În molecula de mai jos (N-metil acetamidă) este posibil să se observe conformerul s-cis (ambele grupări metil verzi pe aceeași parte a legăturii C-N) și conformerul s-trans (grupări metil verzi pe laturile opuse ale legăturii C-N) separat. Acest lucru, de obicei, nu este posibil pentru conformers excepția cazului în care luați temperatura până la 100 Kelvin sau cam asa ceva!
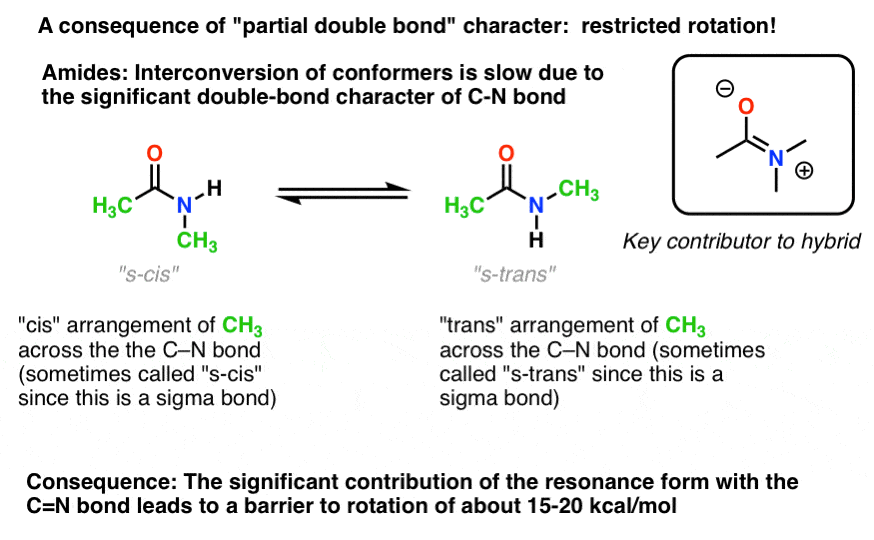
pentru imaginea de mai sus, conceptul crucial aici este doar caracterul parțial de legătură dublă. Dacă s-cis și s-trans nu au sens pentru tine după ce te-ai gândit puțin, este în regulă., Nu este crucial pentru restul discuției.
consecințele conjugării (3): reactivitatea unui sistem conjugat este adesea dezvăluită de forma sa de rezonanță „a doua cea mai bună”
am arătat efectul pe care conjugarea (și prin extensie, rezonanță) îl are asupra lungimilor legăturii.să aruncăm o privire mai atentă asupra efectului său asupra densității electronice, care în cele din urmă influențează reactivitatea.
în scopuri ilustrative, să continuăm să ne uităm la alchene.reactivitatea unei alchene poate fi modificată dramatic prin atașarea diferitelor grupuri.,uitați-vă la forma de rezonanță” a doua cea mai bună ” atunci când atașăm un donator pi, cum ar fi N(CH3)2 la o alchenă. Acest lucru duce la o acumulare de sarcină negativă (δ–) la borna de carbon din alchene, cu rezultatul că acest alchene (pe care noi o numim o enamine) este un excelent nucleofil. Pentru a lua doar un exemplu proeminent, enamines reacționează cu halogenurile de alchil (cum ar fi CH3I) și alte electrofile într-o clasă de reacții uneori menționată ca Barza Enamine reacții după descoperitorul lor, Gilbert Barza. Alchenele obișnuite, cum ar fi 2-butena (de mai jos), nu funcționează în această reacție.,
Atașament de un pi-acceptor, cum ar fi C=O rezultă într-o acumulare de sarcină pozitivă (δ+) la borna de carbon din alchene, cu rezultatul că această specie (ceea ce noi numim un α, β-nesaturate aldehidă, Michael acceptor, sau enone) este un excelent electrofil. α, β-nesaturate carbonyls reacționează cu nucleofililor (cum ar fi CH3S–) și multe alte clase de nucleofililor într-un tip general de reacție numim conjugat completări sau, uneori, Michael reacții.,
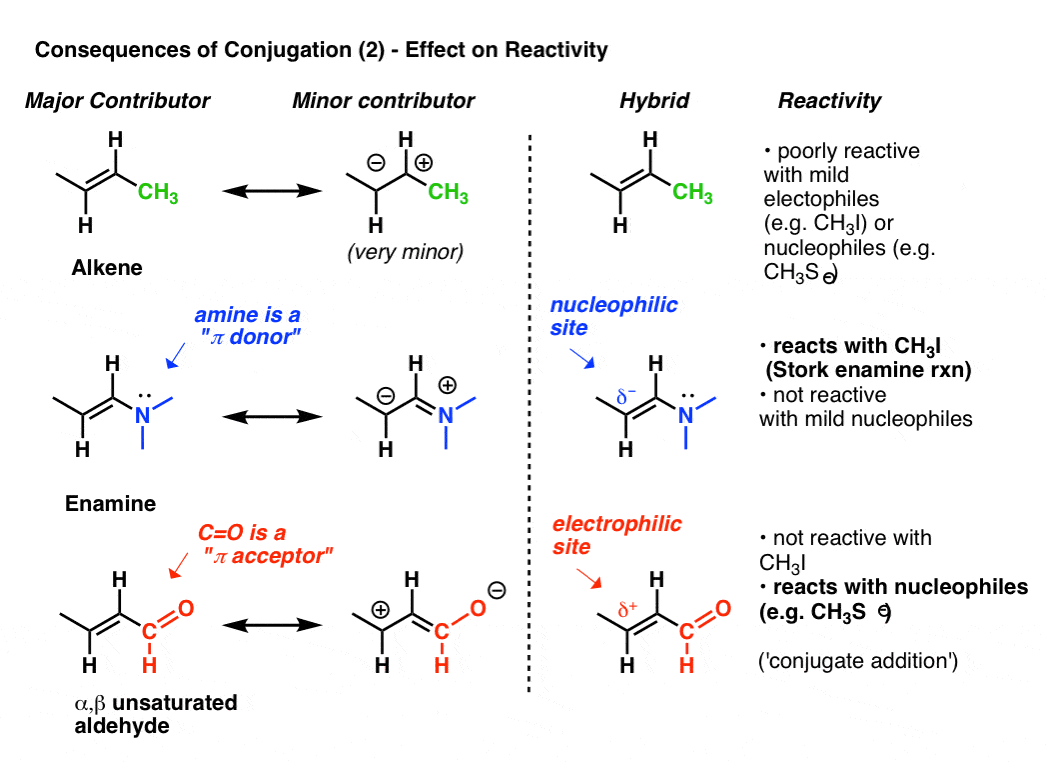
acesta este doar vârful aisbergului cu privire la modul în care conjugarea poate afecta reactivitatea, dar este suficient pentru ziua de azi.
9., Orbitali se Suprapun (Tot p-Orbitali În Același Plan) Este Necesar Pentru Conjugarea (Și de Rezonanță)
până acum am văzut că:
- suprapunere între orbitalii p este necesar pentru a forma pi obligațiuni
- unele „singur obligațiuni” poate avea „pi bond caracter” datorează contribuție de la un minor de rezonanță de formă (cum ar fi amide, de exemplu)
Aici este consecința logică a acestor două declarații:
- În scopul de conjugare a exista, și, prin urmare, în scopul de rezonanță să apară, toți orbitalii p trebuie să se suprapună. Prin urmare, toate acestea trebuie să fie aliniate în același plan.,
amintiți-vă „cationul de alil” care este „stabilizat prin rezonanță”? Pentru ca carbocația să obțină această „stabilizare a rezonanței”, orbitalul p gol pe carbocație trebuie aliniat cu legătura pi adiacentă.dacă orbitalul p se află la un unghi de 90 de grade față de orbitalii p în legătura pi, nu există conjugare și, prin urmare, nu există stabilizare de rezonanță.
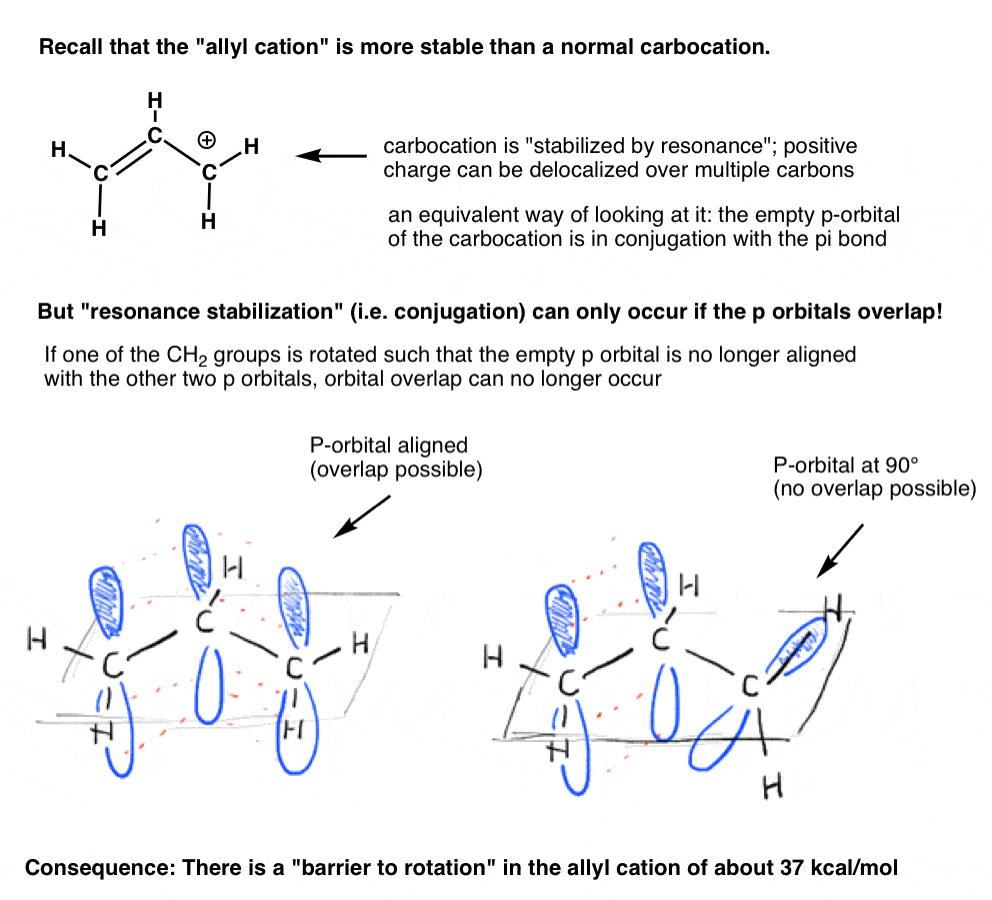
așa cum am putea prezice, există o barieră în calea rotației în cationul de alil, la fel cum există o barieră în calea rotației într-o alchenă., Bariera de rotație în cationul de alil este de aproximativ 37 kcal/mol – puțin mai mult de jumătate din puterea unei legături C-C pi.de asemenea, am văzut că legătura C-N din amide are caracter parțial de legătură dublă, cu o barieră de rotație de aproximativ 15-20 kcal/mol.
De asemenea, acest caracter „legătură dublă parțială” este posibil numai dacă orbitalul P care conține perechea singuratică este capabil să se suprapună cu orbitalii p care conțin legătura C=O pi.,
caracterul dublu parțial al legăturii C-N din amide a fost mult timp considerat a fi principalul motiv pentru care sunt mult mai rezistente la rupere decât, să zicem, esterii . Deoarece proteinele din corpul nostru sunt unite prin legături peptidice (amide), aceasta este o chestiune de importanță mică! Formele de viață bazate pe ester, mai degrabă decât legăturile amidice, ar fi mult mai fragile!,amidele capului de pod nu sunt conjugate și sunt mult mai ușor rupte decât amidele „obișnuite”
amidele capului de pod oferă o ilustrare a ceea ce se întâmplă cu amidele atunci când suprapunerea este imposibilă.
așa cum am văzut în cap de pod alchene, în pod amide, orbital suprapunere între azot singuratic pereche și carbonil de carbon este imposibil din cauza răsucirii. Rezultatul este că legătura C-N nu are caracter de legătură dublă parțială și este mult mai ușor de rupt decât o amidă „normală”.Amida capului de pod de mai jos este „quinuclidona”, o amidă răsucită care a evitat sinteza timp de decenii., Abia în 2006 a fost făcută în cele din urmă (ca acid conjugat) printr-un traseu inteligent de către laboratorul lui Brian Stoltz de la Caltech.
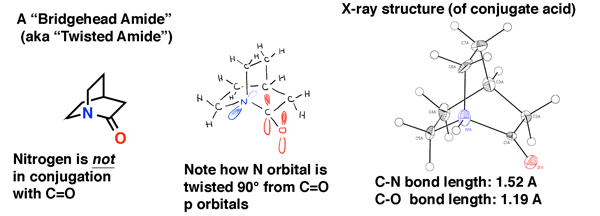
structura cristalelor cu raze X este martoră a lipsei de conjugare în această amidă. Lungimea legăturii C-N este de 1,52 Å (tipică pentru o singură legătură C-N), iar lungimea legăturii C=O este de 1,19 Å, ceea ce este tipic pentru o lungime a legăturii într-o aldehidă sau cetonă (1,20 Å). Prin urmare, ne-am aștepta ca acesta să fie destul de puțin mai instabil față de atacul nucleofilic decât o amidă normală, care a fost confirmată în studiul laboratorului Stoltz.,
mai multe consecințe ale conjugării: culoare și Cicloadiții
până în prezent, acest post a fost destul de mult o revizuire a conceptelor semestrului 1st. Nu există nimic în discuția de mai sus care să nu poată fi explicat în mod rezonabil prin ceea ce am învățat deja despre conjugare și rezonanță.cu toate acestea, această abordare simplistă nu ne poate duce decât până acum.
două exemple rapide, pentru că această postare a durat destul de mult.,dacă ați văzut această postare despre cum funcționează înălbitorul, ați aflat că, pe măsură ce prelungim lungimea conjugării, schimbăm lungimea de undă la care moleculele absorb lumina. Unele molecule foarte viu colorate, cum ar fi carotenul, clorofila și licopenul, toate au legături duble conjugate foarte lungi.de exemplu, licopenul este responsabil pentru culoarea roșie a roșiilor. Dacă eliminăm legăturile duble, eliminăm culoarea. De ce?
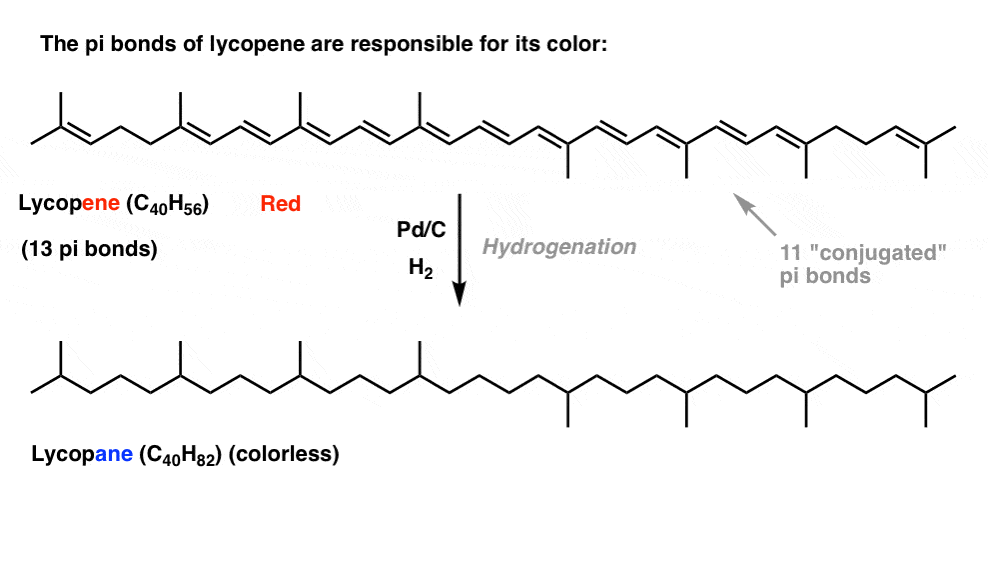
care este relația dintre culoare și conjugare?, De ce numărul de obligațiuni duble ar avea o influență asupra acestui lucru? Rezonanța nu reușește să lumineze acest subiect.
În al doilea rând: reacțiile dienelor care formează inele
iată câteva reacții ciudate pentru tine.dacă tratați butadiena cu molecula din dreapta sa (maleat de metil), obțineți un produs nou care conține un inel cu șase membri. Nimic din ce am văzut până acum nu ne pregătește pentru acest tip de reacție, care se numește „cicloadiție”.interesant este că dacă tratați etena cu aceeași moleculă, nu se întâmplă nimic (cu excepția cazului în care o tratați cu lumină UV., Apoi, veți obține un inel cu 4 membri, dar eu digresiune).
De ce?
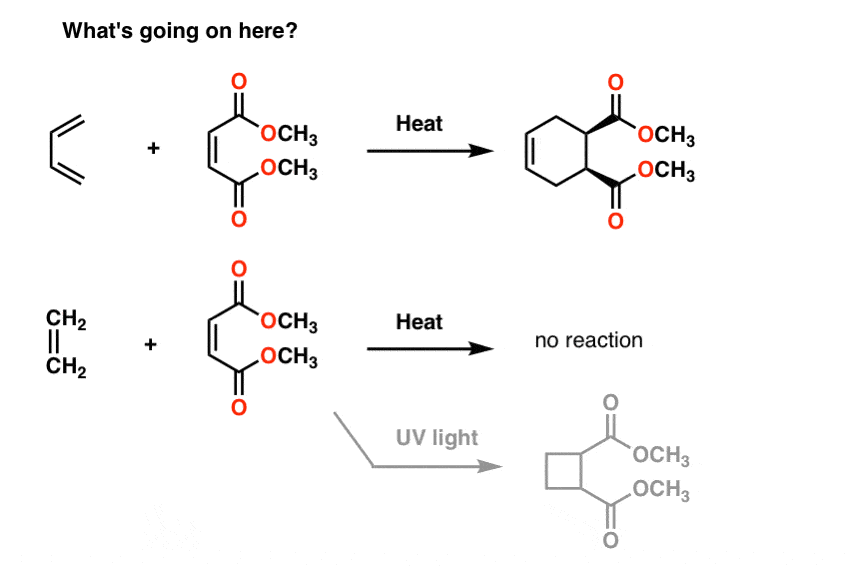
rezonanța nu ne ajută nici aici.ce ne va ajuta să răspundem la aceste întrebări, precum și la multe altele care merg înainte este un concept numit teorie orbitală moleculară.
în următoarele posturi din această serie, vom săpa mai adânc în modul în care orbitalii p se suprapun pentru a forma orbitali moleculari și vom examina nivelurile de energie ale acestor orbitali., Vom vedea, de asemenea, cum acest lucru influențează reactivitatea moleculelor și ne permite să facem predicții despre comportamentul lor chimic.după cum vom vedea, teoria orbitală moleculară ne oferă un set foarte puternic de concepte care ne vor ajuta să înțelegem reactivitatea chimică la un nivel mult mai profund.vă mulțumim pentru Tom Struble pentru tot ajutorul său cu acest post.
Note
tulpina A-1,2 este motivul pentru care tetra-terț-butiletilena nu a fost încă sintetizată.legăturile pi nu sunt conjugate. Uită-te la orbitalii cuprinzând cele două legături pi., Ele sunt în unghi drept unul față de celălalt și nu se pot suprapune.
folosind RMN, spectroscopie de rezonanță magnetică nucleară. Acești izomeri conformaționali sunt uneori numiți „izomeri rotativi” sau „rotameri” și pot complica considerabil spectrele RMN. Vârfurile pot fi de obicei făcute să se coaguleze prin încălzirea sondei de probă.acest lucru este în contrast cu, să zicem, diferite forme de scaun de ciclohexan, care, în general, pot încă să se interconvertească la temperatura camerei și să se coaguleze la un singur vârf., Cu toate acestea, dacă răciți suficient un ciclohexan substituit, puteți „îngheța” diferitele conformeri și le puteți observa separat.




