
Sabonetes são agentes de limpeza que são feitas geralmente através de uma reacção álcalis (por exemplo, hidróxido de sódio) que ocorre naturalmente com gordura ou ácidos graxos. A reação produz sais de sódio desses ácidos graxos, que melhoram o processo de limpeza, tornando a água mais capaz de retirar manchas gordurosas da pele, cabelo, roupas e quase tudo mais., Como uma substância que tem ajudado corpos limpos, bem como posses, sabão tem sido extremamente útil.
História do sabão
a descoberta do sabão antecede a história registrada, voltando talvez até seis mil anos atrás. Escavações da antiga Babilônia descobriram cilindros com inscrições para fazer sabão em torno de 2800 B. C. E. mais tarde registros do antigo Egito (c. 1500 B. C. E. ) descrevem como os óleos animais e vegetais foram combinados com sais alcalinos para fazer sabão. de acordo com a lenda romana, sabonete recebeu seu nome do Monte Sapo, onde animais foram sacrificados., A chuva lavaria a gordura dos animais sacrificados, juntamente com as cinzas de madeira alcalina dos fogos de sacrifício para o Rio Tiber, onde as pessoas encontraram a mistura ajudou a limpar as roupas. Esta receita para fazer sabão foi relativamente inalterada por séculos, com colonos americanos coletando e cozinhando baixo sebo animal (gordura fundida) e, em seguida, misturando-o com uma solução de potassa alcalina obtida a partir das cinzas acumuladas de madeira dura de seus incêndios de Inverno. Da mesma forma, os europeus fizeram algo conhecido como sabonete de Castela com óleo de oliva., Só desde meados do século XIX é que o processo se tornou comercial e o sabão se tornou amplamente disponível no mercado local.
a Química do Sabão
A estrutura básica de todas as novelas é essencialmente o mesmo, consistindo de um longo hidrofóbica (água temente a) de hidrocarbonetos “cauda” e uma hidrofílica (waterloving) aniônico “cabeça”:
CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 COO − ou CH 3 (CH 2 ) n COO −
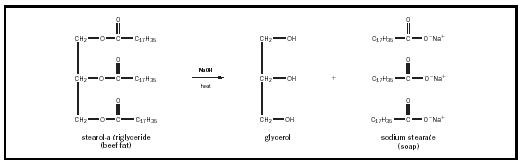
O comprimento de hidrocarboneto de cadeia (“n”) varia de acordo com o tipo de óleo ou gordura, mas é geralmente bastante longo., A carga aniônica sobre a cabeça de carboxilato é geralmente equilibrada por uma carga positiva de potássio (K + ) ou de sódio (na + ) catião. Na fabricação de sabão, triglicéridos em gorduras ou óleos são aquecidos na presença de uma forte base alcalina, como hidróxido de sódio, produzindo três moléculas de sabão para cada molécula de glicerol. Este processo é chamado de saponificação e é ilustrado na Figura 1. tal como os detergentes sintéticos, os sabões são substâncias “tensioactivos” e, como tal, melhoram a qualidade da água nas superfícies de limpeza., A água, apesar de ser um bom solvente geral, é também, infelizmente, uma substância com uma tensão superficial muito elevada. Por causa disso, as moléculas de água geralmente preferem ficar juntas ao invés de molhar outras superfícies. Os surfactantes trabalham reduzindo a tensão superficial da água, permitindo que as moléculas de água molhem melhor a superfície e, assim, aumentar a capacidade da água para dissolver manchas sujas e oleosas.
no estudo de como o sabão funciona, é útil considerar uma regra geral da natureza: “como dissolve como.,”As caudas hidrofóbicas não-solares de sabão são lipofílicas (“amantes do óleo”) e, assim, vai embutir na gordura e óleos que ajudam a sujeira e manchas aderem às superfícies. As cabeças hidrofílicas, no entanto, permanecem rodeadas pelas moléculas de água para as quais são atraídas. À medida que cada vez mais moléculas de sabão se incorporam em uma mancha gordurosa, elas eventualmente cercam e isolam pequenas partículas da gordura e formam estruturas chamadas micelas que são levantadas em solução., Em uma micela, as caudas das moléculas de sabão são orientadas para a gordura e para a gordura, enquanto as cabeças viradas para fora na água, resultando em uma emulsão de partículas de gordura gordurosa suspensas na água. com agitação, as micelas são dispersas na água e removidas da superfície previamente suja. Em essência, as moléculas de sabão dissolvem parcialmente a mancha gordurosa para formar a emulsão que é mantida suspensa na água até que possa ser enxaguada (ver Figura 2). por mais boas que sejam as sabonetes, não são perfeitas., Por exemplo, eles não funcionam bem em água dura contendo íons de cálcio e magnésio, porque os sais de cálcio e magnésio do sabão são insolúveis; eles tendem a se ligar aos íons de cálcio e magnésio, eventualmente precipitando e caindo da solução. Ao fazer isso, Sabonetes realmente sujam as superfícies que foram projetadas para limpar. Assim, os sabões foram substituídos em grande parte em soluções de limpeza modernas por detergentes sintéticos que têm um grupo de sulfonato (R-SO 3 − ) em vez da cabeça de carboxilato (R-COO − )., Os detergentes com sulfonato tendem a não precipitar com iões de cálcio ou magnésio e são geralmente mais solúveis em água. apesar de a popularidade do sabão ter diminuído devido a detergentes superiores, um dos principais usos do sebo animal ainda é para fazer sabão, assim como foi em anos anteriores. Além de sua capacidade de limpeza, sabão tem sido usado em outras aplicações. Por exemplo, certos sabões podem ser misturados com gasolina para produzir napalm gelatinoso, uma substância que queima mais lentamente do que a gasolina pura quando inflamada ou explodida em guerra., Sabões também são usados em” calor enlatado”, uma mistura comercializada de sabão e álcool que pode ser inflamado e usado para cozinhar alimentos ou fornecer calor. No geral, o sabão é uma substância extremamente útil, tal como tem sido durante milhares de anos.




