The chemical element rubidium is classed as an alkali metal. It was discovered in 1861 by Robert Bunsen and Gustav Kirchhoff.

Data Zone
| Classification: | Rubidium is an alkali metal |
| Color: | silvery-white |
| Atomic weight: | 85.,468 |
| State: | solid |
| Melting point: | 39.3 oC, 312.45 K |
| Boiling point: | 690 oC, 963 K |
| Electrons: | 37 |
| Protons: | 37 |
| Neutrons in most abundant isotope: | 48 |
| Electron shells: | 2,8,18,8,1 |
| Electron configuration: | 5s1 |
| Density @ 20oC: | 1.,53 g/cm3 |
Show more, including: Heats, Energies, Oxidation,
Reactions, Compounds, Radii, Conductivities
| Atomic volume: | 55.9 cm3/mol |
| Structure: | bcc: body-centered cubic |
| Hardness: | 0.3 mohs |
| Specific heat capacity | 0.363 J g-1 K-1 |
| Heat of fusion | 2.192 kJ mol-1 |
| Heat of atomization | 81 kJ mol-1 |
| Heat of vaporization | 72.,216 kJ mol-1 |
| 1st ionization energy | 403 kJ mol-1 |
| 2nd ionization energy | 2632.1 kJ mol-1 |
| 3rd ionization energy | 3859.4 kJ mol-1 |
| Electron affinity | 46.885 kJ mol-1 |
| Minimum oxidation number | 0 |
| Min. common oxidation no. | 0 |
| Maximum oxidation number | 1 |
| Max. common oxidation no. | 1 |
| Electronegativity (Pauling Scale) | 0.,82 |
| volume de polarização | 47.,O, Rb2O2, Rb2O3, RbO2 (brown rubidium superoxide) |
| Hydride(s) | RbH |
| Chloride(s) | RbCl |
| Atomic radius | 248 pm |
| Ionic radius (1+ ion) | 166 pm |
| Ionic radius (2+ ion) | – |
| Ionic radius (3+ ion) | – |
| Ionic radius (1- ion) | – |
| Ionic radius (2- ion) | – |
| Ionic radius (3- ion) | – |
| Thermal conductivity | 58.,2 W m-1 K-1 |
| condutividade Elétrica | 47.8 x 106 S m-1 |
| Congelamento/ponto de Fusão: | 39.3 oC, 312.45 K |

Rubídio em um tubo de vidro. Image by Dennis S. K (1).
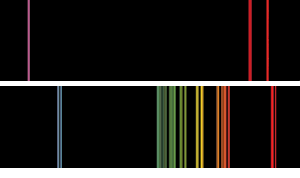
espectros básicos de emissão de chama do tipo que Bunsen e Kirchoff poderiam ter visto. O espectro superior é o potássio, com a linha Violeta distintiva., No caso do rubidium, as linhas vermelhas de rubi gêmeas mais distantes na parte vermelha do espectro do que Bunsen e Kirchoff já haviam visto antes indicavam a presença de um novo elemento.
a Descoberta de Rubídio
Rubídio foi descoberto em 1861, em Heidelberg, na Alemanha, por Robert Bunsen e Gustav Kirchhoff usando espectroscopia, o método que o par tinha inventado e desenvolvido nos dois anos anteriores., no coração do espectroscópio havia um prisma de vidro, que dividia a luz vinda de uma chama em um espectro – muito da mesma forma que as gotas de chuva podem dividir a luz solar em um arco-íris. O espectroscópio ampliou o espectro para permitir que ele fosse estudado em detalhes.quando Bunsen e Kirchhoff colocaram sais diferentes na chama do queimador Bunsen recentemente inventado, eles viram linhas coloridas em cada um dos Espectros que tomaram. excitantemente, eles descobriram que estas linhas coloridas eram únicas para qualquer substância que fosse queimada., As linhas de um espectro eram uma forma de “impressões digitais” de um elemento. Bunsen e Kirchoff descobriram césio em 1860 quando analisaram o espectro da água mineral.em 1861, eles começaram a estudar a lepidolita mineral (lítio, potássio e silicato de alumínio) que havia sido encontrada na Saxônia, Alemanha. (2) Bunsen e Kirchoff utilizaram ácido hidrocloroplatânico para precipitar cloroplatinato de potássio a partir do mineral. No cloroplatinato de potássio encontraram outro sal. (2,3)
colocando este sal no queimador de Bunsen, eles viram seu espectro continha muitas linhas novas., Duas dessas linhas foram particularmente notáveis.
em suas notas Bunsen e Kirchoff escreveu: “nenhuma das linhas pertence a qualquer corpo anteriormente conhecido. Entre eles estão dois que são particularmente notáveis em estar além da linha de Fraunhofer na parte mais externa do espectro solar vermelho. Assim, propomos para este novo metal o nome rubidium (e o símbolo Rb) do latim rubidius, que foi usado para expressar a cor vermelha mais escura.”(3)
Bunsen was able to extract rubidium metal from its chloride salt by electrysis., Ele descobriu que o metal era mais eletropositivo do que potássio e água decomposta libertando hidrogênio. (4)
a concentração de rubídio na lepidolite tinha sido tão pequena que Bunsen e Kirchoff precisavam processar 150 kg (330 lb) do minério para extrair metal suficiente para estudar suas propriedades. (2)
Rubidium’s Periodic Table Neighborhood
Rubidium behaves like a typical Group 1 metal. É macio e reage violentamente com água. O rubídio segue o potássio no Grupo 1, pelo que as suas reacções são mais violentas do que as do potássio. o rubídio torna-se líquido a 39,3 oC (102.,7 oF) – a little higher than your body temperature.
| Group 1 | Group 2 | Group 3 | |
| 4 | 19 K |
20 Ca |
21 Sc |
| 5 | 37 Rb |
38 Sr |
39 Y |
| 6 | 55 Cs |
56 Ba |
57 La |

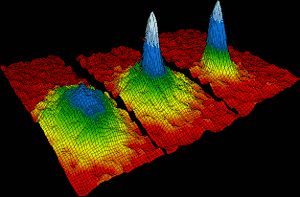
rubidium atoms came together in 1995 to form the first ever Bose-Einstein condensate. Dentro de 170 bilionésimos de um grau de zero absoluto, cerca de dois mil átomos individuais de rubídio se reuniram para formar um único átomo gigante, que se comportou como uma única espécie. A imagem da esquerda mostra a situação antes do condensado se formar. À direita, as cores branca e azul mostram a alta densidade do átomo gigante., Eric Cornell, Carl Wieman e Wolfgang Ketterle ganharam o Prêmio Nobel de Física de 2001 por suas realizações em fazer condensados de Bose Einstein.
Aparência e Características
efeitos Nocivos:
Rubídio não é conhecido por ser tóxico.
Características:
rubídio é um elemento metálico macio e branco prateado. É sólido à temperatura ambiente, mas derrete facilmente, a 39,3 oC.,como os outros metais do grupo 1, o rubídio reage violentamente com água, formando hidróxido de rubídio corrosivo (RbOH) e gás hidrogênio, que é inflamado pelo calor da reação.o rubídio também pode inflamar-se espontaneamente no ar. Forma ligas com césio, ouro, sódio e potássio e forma amálgamas com mercúrio.o rubídio queima com uma cor de chama violeta-avermelhada.
os usos de rubídio
rubídio é usado em células fotoeléctricas, como um getter (removedor de gases vestigiais) em tubos de vácuo e como fluido de trabalho em turbinas a vapor.,
Rubidium-87 é ligeiramente radioactivo e tem sido usado extensivamente em Rochas de datação.os compostos de rubídio apresentam uma cor púrpura nos fogos de artifício.os sais de rubídio são usados em vidros e cerâmica.
Abundância e Isótopos
Abundância crosta terrestre: 90 partes por milhão em peso, de 21 de partes por milhão por toupeiras
Abundância sistema solar: 30 partes por bilhão, em peso, de 0,4 partes por bilhão por toupeiras
o Custo puro: $1200 por 100g
o Custo, a granel: $ por 100 g
Fonte: O principal minério de rubídio é lepidolite, que contém 1,5% de rubídio., O rubídio é geralmente obtido como um produto da produção de lítio. Rubidium metal também pode ser produzido pela redução de cloreto de rubídio com cálcio.isótopos
: o rubídio tem 29 isótopos cujas semi-vidas são conhecidas, com números de massa de 74 a 102. Rubídio de ocorrência natural é uma mistura de dois isótopos, 85Rb e 87Rb com abundância natural de 72,2% e 27,8%, respectivamente.,

Citar esta Página
Para on-line linking, por favor copie e cole um dos seguintes procedimentos:
<a href="https://www.chemicool.com/elements/rubidium.html">Rubidium</a>
ou
<a href="https://www.chemicool.com/elements/rubidium.html">Rubidium Element Facts</a>
Para citar esta página em um documento acadêmico, por favor, use as seguintes MLA compatível com citação de:
"Rubidium." Chemicool Periodic Table. Chemicool.com. 18 Oct. 2012. Web. <https://www.chemicool.com/elements/rubidium.html>.




