um ligante é um íon ou molécula que se liga a um átomo de metal central para formar um complexo (alternativamente conhecido como uma entidade de coordenação).

ligandos são geralmente considerados dadores de electrões atraídos para o metal no centro do complexo. Os metais são aceitadores de electrões.
ligandos podem ser espécies neutras ou negativamente carregadas com pares de elétrons disponíveis. A água é um ligante comum., Aqui uma molécula de água é mostrada com seus dois pares solitários de elétrons.

um par de elétrons do ligante, como a água, fornece ambos os elétrons para a ligação que se forma entre si e o átomo de metal central ou íon.
Aqui um único ligante L, que pode ser água, doa um par de elétrons para formar uma ligação com um átomo de metal M.
Monodentate Ligandos
Monodentate ligantes têm apenas um átomo capaz de se ligar a uma central de metal átomo ou íon.
H20 e NH3 são exemplos de ligantes monodentados neutros., quando H20 é um ligante, oxigênio é o átomo doador ligando-se ao metal. Quando NH3 é um ligante, nitrogênio é o átomo doador ligando-se ao metal.exemplos de ligantes monodentados carregados eletricamente são íons de haleto, tais como: F-, Cl-, Br-, I-, e ciano, CN-.
a carga geral sobre um complexo é a soma aritmética do Estado de oxidação do metal no centro mais a carga(s) trazida ao complexo por cada ligante.
ligandos Polidentados
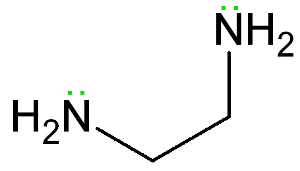 exemplo de ligante bidentado., Etano-1,2-diamina tem dois pares solitários de elétrons mostrados em verde.
exemplo de ligante bidentado., Etano-1,2-diamina tem dois pares solitários de elétrons mostrados em verde.
uma molécula de ligante com mais de um átomo doador é um ligante polidentado. Estes são dados nomes específicos, dependendo de quantos átomos doadores eles contêm.os ligantes Bidentados têm dois átomos capazes de se ligarem a um átomo de metal central ou a um íon.
etano-1,2-diamina (mostrado na imagem) é um exemplo de ligante bidentado. ambos os nitrogénios desta molécula podem actuar como dadores de electrões, ligando-se a um átomo metálico central ou a um ião.,outros exemplos de ligantes bidentatos são o íon acetilacetonato, conhecido como (acac), e o íon oxalato (Ox).
exemplo de um ligante tridentado. 1,4,7-triazaheptano (também conhecido como dietilenotriamina) tem três pares solitários de elétrons mostrados em verde.
ligantes Tridentatos e ligantes Polidentatos superiores
ligantes Tridentatos têm três átomos capazes de se ligar a um átomo de metal central ou ião.,moléculas com quatro átomos doadores são chamadas ligantes tetradentatos; cinco átomos doadores, pentadentato; e seis átomos doadores hexadentato.
um complexo que contém um ligante polidentato é chamado de quelato.
A imagem mostrada abaixo da ligação EDTA a um átomo de metal central é um exemplo de quelato. Veja também os compostos da coroa.
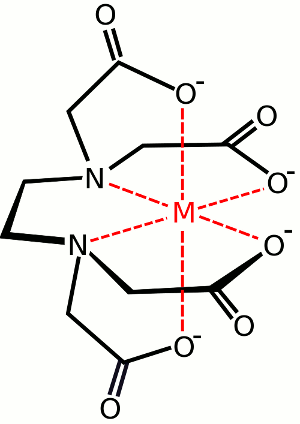 exemplo de um ligante hexadentato. EDTA (também conhecido como ácido etilenodiaminotetraacético). A imagem mostra um complexo formado entre EDTA e uma espécie de metal central.,Se o metal foram Fe no estado de oxidação III, o complexo seria –
exemplo de um ligante hexadentato. EDTA (também conhecido como ácido etilenodiaminotetraacético). A imagem mostra um complexo formado entre EDTA e uma espécie de metal central.,Se o metal foram Fe no estado de oxidação III, o complexo seria –
Ambidentate Ligandos
Ambidentate ligandos são monodentate ligantes que podem se ligar em dois lugares possíveis. Por exemplo, o íon nitrato NO2 – pode se ligar ao átomo de metal central/íon no átomo de nitrogênio ou um dos átomos de oxigênio.O íon tiocianato, SCN-pode se ligar ao metal central em enxofre ou nitrogênio.




