de Conjugação Química Orgânica: Definição, Exemplos, Exploração e Consequências
Este é o primeiro de uma série de posts que irá cobrir conjugação, pi sistemas, teoria de orbitais moleculares, dienos, 1,2 e 1,4 – adições, o Diels Alder reação e outros pericyclic reações. Vamos começar por rever o básico!,Revelado Pelo Seu “Segundo Melhor” Ressonância de Formulário
Revisitar o Pi Bond (e Pi união): “de Lado” Orbital Sobreposição Entre Adjacente p-Orbitais
Uma das primeiras coisas que você aprende alcenos é que a rotação sobre o C-C pi (π) bond não ocorre., Por exemplo, a temperaturas e pressões normais., trans-2-buteno (mostrado abaixo à esquerda) nunca se observa a conversão espontânea para cis-2-buteno (direita) . São compostos separáveis, com diferentes pontos de fusão e ebulição. Você pode comprar cada um deles separadamente de Aldrich. Isto não seria possível se houvesse rotação livre sobre a dupla ligação.,
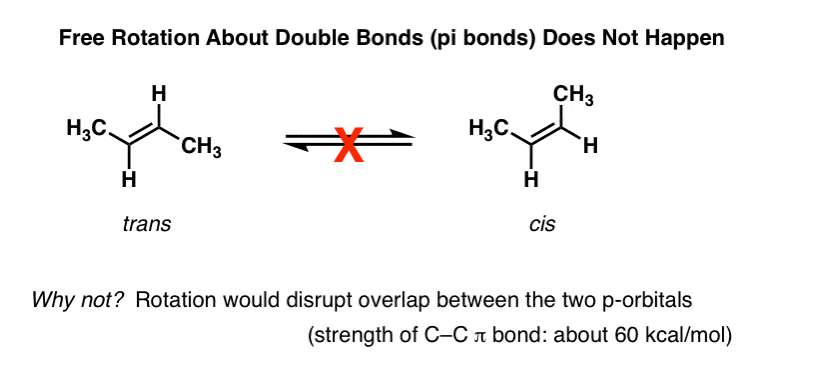
escavando mais fundo nisto, vimos que isso é devido a um fenômeno chamado “ligação pi” – uma sobreposição lateral de dois orbitais p adjacentes, cada um contendo um elétron, o que resulta em uma orientação preferida onde os orbitais p “se alinham” ao lado um do outro, como soldados. Devido à geometria do p-orbital, sobreposição não é possível quando os dois p-orbitais estão a 90° um do outro, o que explica essa “barreira rotacional”.,
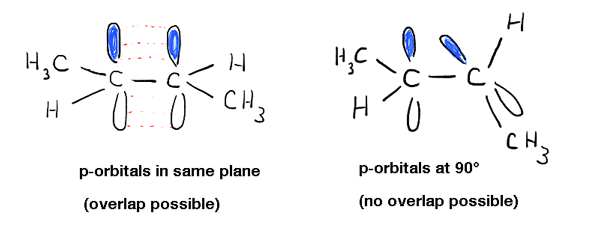
isto tem outras consequências físicas além da barreira de rotação: também influencia a geometria molecular. Uma vez que a ligação Pi é um fenômeno exclusivo dos orbitais p, isso significa que cada ligação pi em que um átomo participa deixará um p-orbital disponível para “hibridização” com a orbital s no átomo. This results in the familiar “trigonal planar” (sp2 ) geometry for typical alkene carbons and “linear” geometry (sp) for alkyne carbons.
portanto, os alcenos são “planos”, ao contrário de carbonos de alquilo, que adotam uma geometria tetraédrica.,
a importância da sobreposição Orbital para a ligação Pi
Uma ilustração vívida da importância da sobreposição orbital é apresentada por um caso em que podemos ingenuamente pensar que uma ligação dupla “deve” formar – se-mas não o faz. Bredt observou em 1924 que os alcenos tendem a não se formar em posições de “cabeça de ponte”, como na molécula na parte inferior esquerda, uma observação que veio a ser chamada de “regra de Bredt”.porque não? Se você fizer o modelo, verá que a geometria do anel bicíclico força esses orbitais p a serem orientados em ângulos retos. Não há sobreposição entre os orbitais p., Portanto, ele se assemelha a um carbono com dois radicais adjacentes mais do que faz uma ligação pi real!
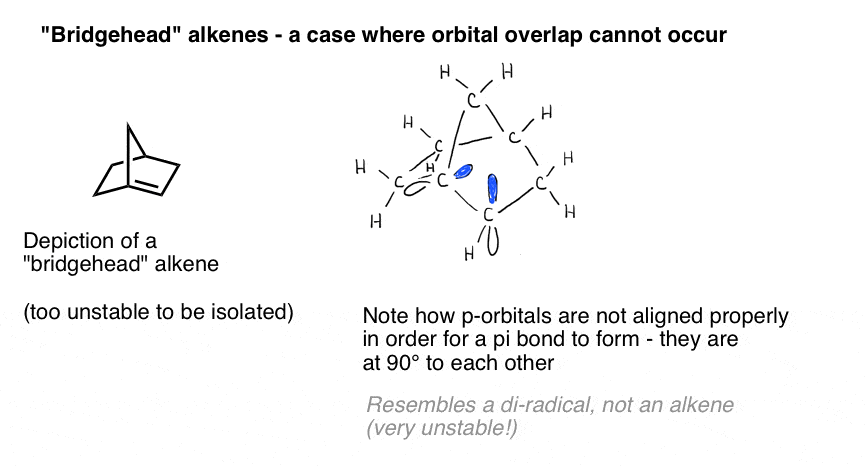
desenhos tridimensionais sobre uma superfície plana não fazem realmente justiça à glória da estrutura tridimensional. Aqui está um modelo e Vídeo de acompanhamento.
essas coisas cor-de-rosa devem ser os orbitais p. Vês como estão em ângulos rectos um com o outro? Isso significa que não se sobrepõem.
via GIPHY
A linha de fundo é que você precisa de sobreposição entre orbitais p para que uma ligação Pi se forme., Em sistemas acíclicos que geralmente não é um problema
3. Além Pi Títulos: “Conjugação” De 3 Ou Mais Orbitais p
No primeiro semestre química orgânica aprendemos que esta sobreposição de orbitais p não é necessariamente restrita aos dois adjacentes p orbitais. Sobreposição pode estender-se além de dois orbitais p para incluir três, quatro, cinco, e ainda mais consecutivos orbitais p em átomos consecutivos, construindo maiores “pi-systems” (Lycopene testemunha, por exemplo).,
também vemos que a definição de ” orbital p “é um pouco flexível, e pode incluir exemplos como
chamamos isso de” construção “de orbitais p em” sistemas pi “maiores,”conjugação”. Em cada uma das moléculas do meio abaixo, o alceno (ligação pi) é conjugado com um orbital p adjacente.
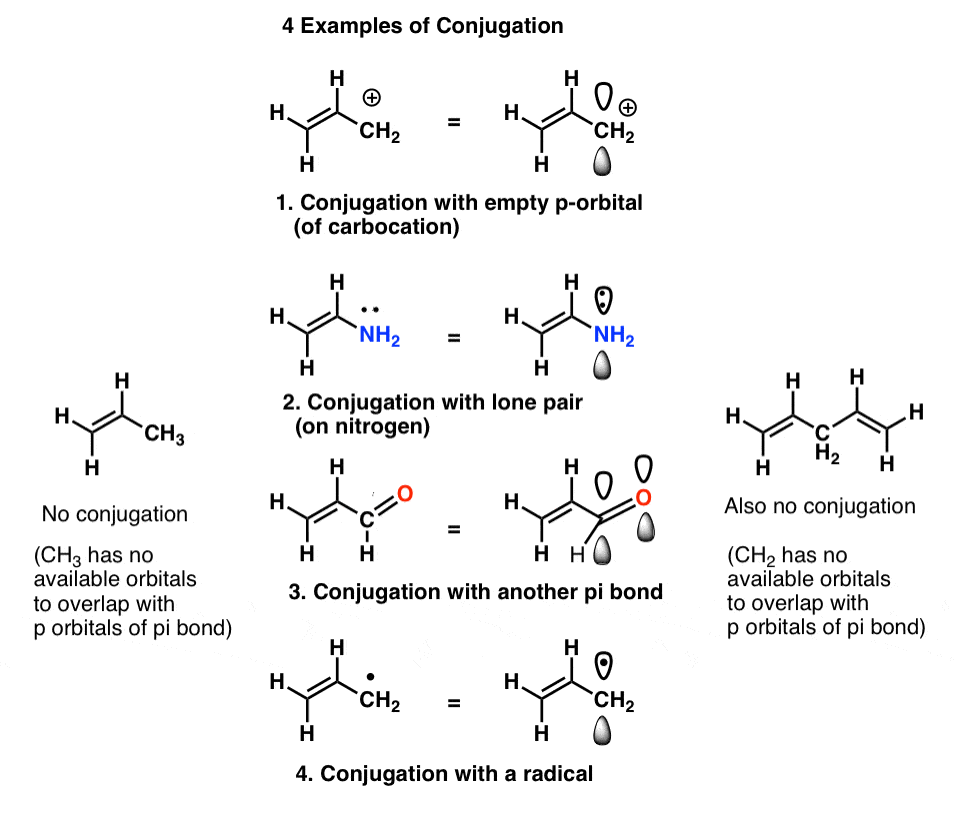
A “conjugação killer” para o observar é um átomo falta solitário pares conectados a única títulos, tais como CH2 no exemplo abaixo (1,4-pentadieno). Estas duas ligações pi não são conjugadas.aqui está uma pergunta engraçada com rasteira., As ligações duplas na molécula abaixo (aleno) são conjugadas? Porquê ou porque não?
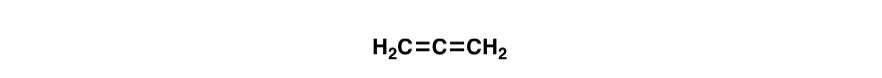
4. A distinção entre conjugação e ressonância
você pode muito bem perguntar: isso soa apenas como ressonância. Qual é a diferença?vamos tomar um segundo para distinguir a conjugação e a ressonância.
- conjugação é o que chamamos Quando 3 ou mais orbitais p se unem em um maior “sistema pi”.,
- estes sistemas pi conjugados contêm elétrons, que muitas vezes chamamos de “elétrons pi” para distingui-los dos elétrons que compõem ligações únicas na molécula.
- os diferentes arranjos de elétrons dentro desse “sistema pi” são chamadas de formas de ressonância.,
Uma grosseira analogia poderia ser assim:
- Acho que da p orbitais como sendo um pouco como “salas” de elétrons (ocupação máxima: 2)
- Juntar vários quartos em um prédio maior é a conjugação
- A diferentes permitidos arranjos de pessoas (elétrons) dentro do edifício são formas de ressonância.
o requisito chave para a conjugação é a sobreposição orbital, que vamos expandir em um pouco.por agora, vamos rever algumas consequências da conjugação.,
Consequências de Conjugação (1): comprimento da ligação
Como eu disse, estamos mais habituados a conjugação no contexto de “ressonância”, um conceito já abordamos antes (e desde que esta série está indo para o segundo semestre território, a pena re-familiarizar-se com)
Por exemplo, com o acetato de lítio (CH3CO2)– e o alil de cátions (ambos mostrado abaixo), vimos que há duas maneiras diferentes de organizar a pi de elétrons, que chamamos de “ressonância de formulários”.,
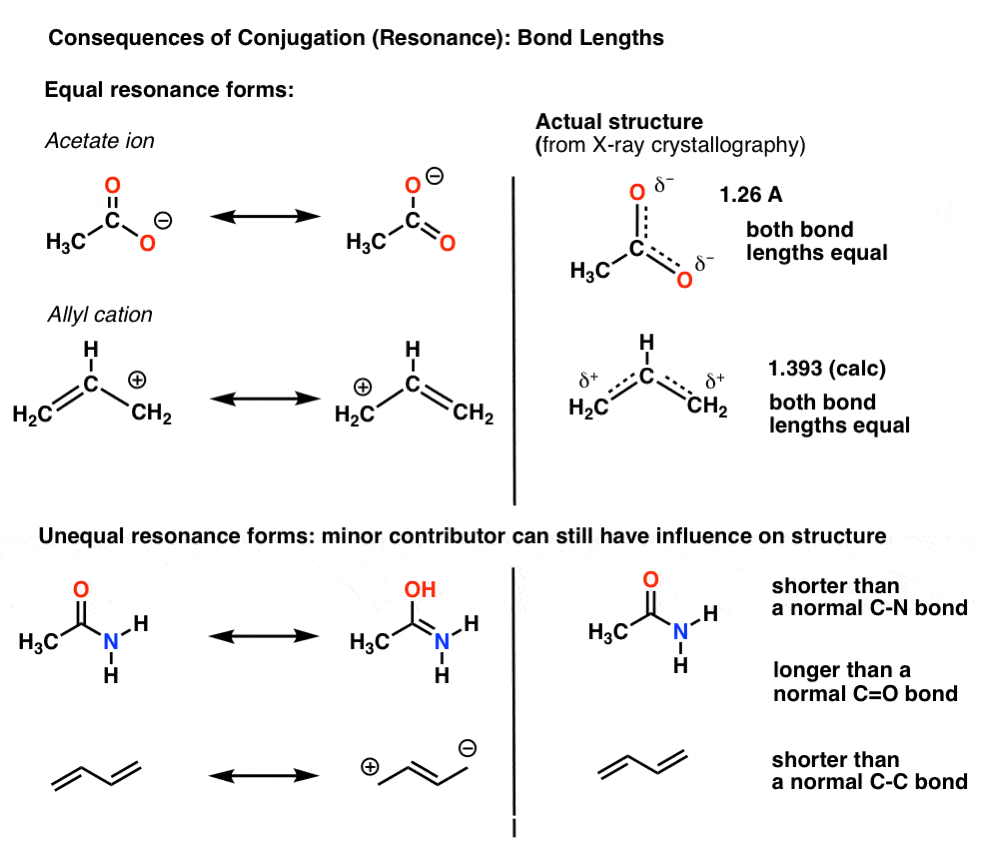
o ponto importante a ser observado é que os elétrons pi não estão constantemente trocando entre átomos; ao invés disso, a estrutura “verdadeira” da molécula é um híbrido dessas formas de ressonância.uma consequência importante da ressonância é o comprimento das ligações intermediárias entre duas formas., quando as formas de ressonância não são idênticas, o híbrido de ressonância será um híbrido” ponderado ” das mais importantes formas de ressonância
no íon acetato e na alilação as duas importantes formas de ressonância são equivalentes, então ambas acabam contribuindo igualmente para o híbrido.
uma situação mais comum é encontrada moléculas como as abaixo há uma mistura de formas de ressonância desiguais. Algumas formas de ressonância são mais importantes do que outras. .,
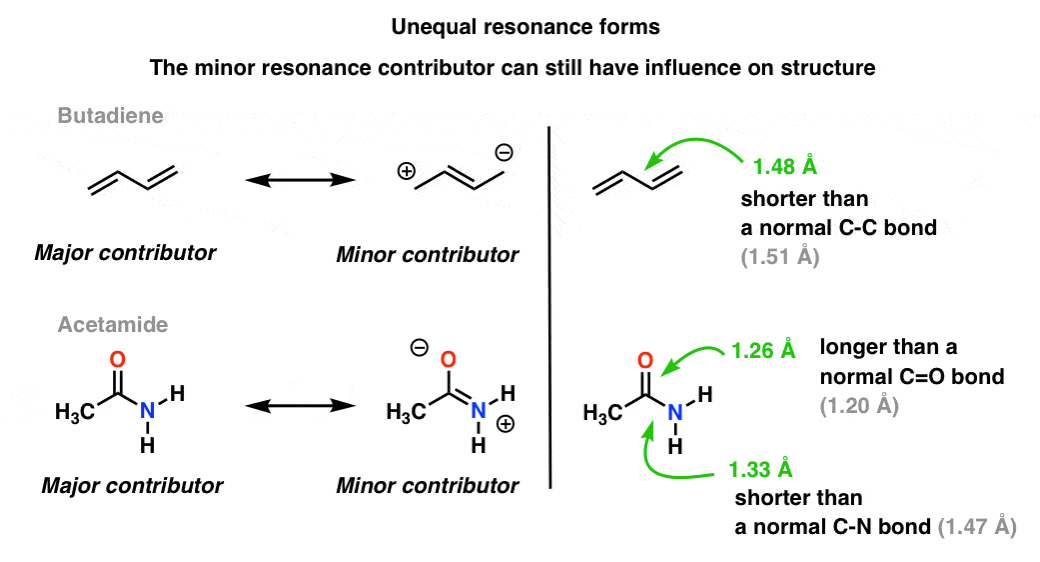
nossa linguagem visual da química com sua distinção nítida entre ligações simples e duplas não descreve com precisão a densidade de elétrons nas moléculas, que são um híbrido ponderado de formas de ressonância. Contribuidores menores de ressonância influenciam os comprimentos de ligação na molécula, tornando-os mais curtos ou mais longos do que o normal.
na molécula de topo (butadieno), essa ligação C-C central é um pouco mais curta que uma ligação C-C “normal” (ou seja, tem um pouco de caráter de ligação dupla) devido à influência do menor contribuinte de ressonância para o híbrido.,
na molécula inferior (“acetamida”) a ligação C-O é um pouco mais longa do que uma ligação “normal” C=o (ou seja, tem mais carácter de ligação única) e a ligação C-N é um pouco mais curta do que uma ligação C-n “normal” (ou seja, tem mais carácter de ligação dupla). Isto reflete a influência do “contribuinte menor” (ou “segundo melhor”, se você quiser) no qual há uma ligação C-n pi e uma única ligação C-O.vamos dar o nosso primeiro salto conceptual.
7., Consequências da conjugação (2): ligações duplas “parciais”
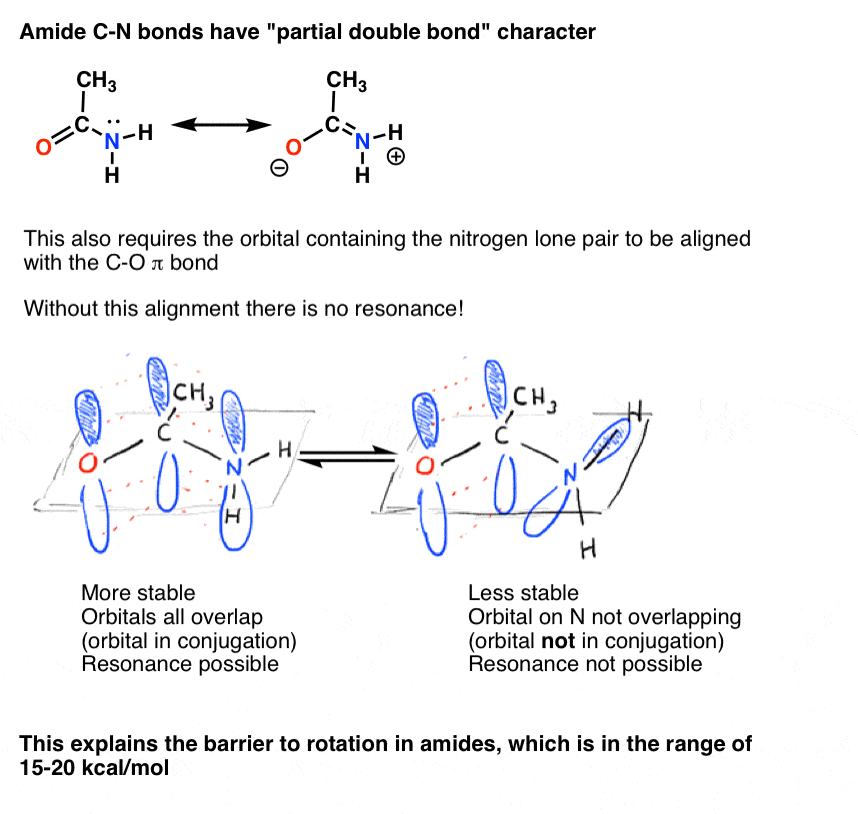
há uma consequência interessante desse “caráter duplo parcial” na ligação C-N. Tem uma ” barreira à rotação “tal como seria de esperar de um”laço duplo”! A barreira à rotação na ligação C-N de amidas é de cerca de 15-20 kcal/mol em ligações peptídicas (comparar com cerca de 2-3 kcal / mol para a maioria das ligações C-C).
O que isto significa é que as duas conformações ainda podem interconverter, mas eles fazem isso relativamente lentamente à temperatura ambiente., Na molécula abaixo (N-metil-acetamida) é possível observar o s-cis conformer (verde grupos metila no mesmo lado do C-N bond) e o s-trans conformer (verde grupos metil em lados opostos do C-N bond) separadamente. Isto normalmente não é possível para os conformadores a menos que você leve a temperatura para baixo para 100 Kelvin ou assim!
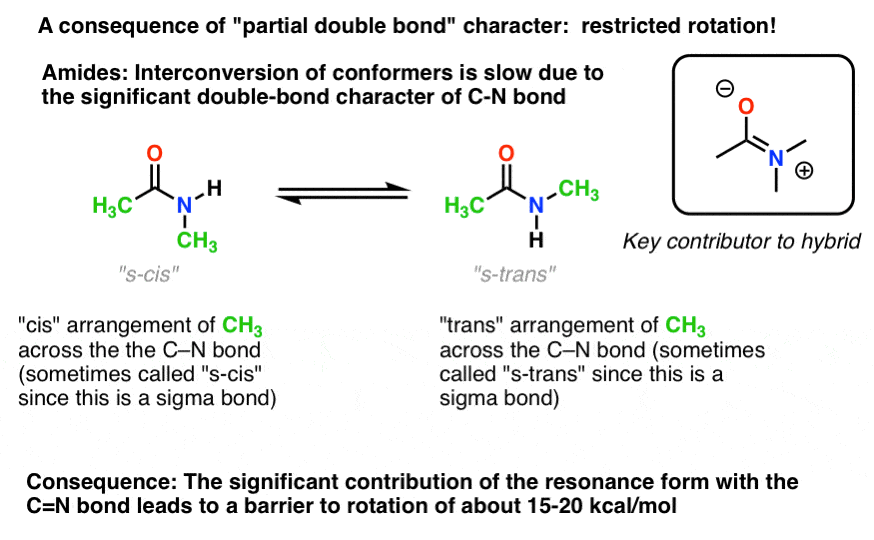
para a imagem acima, o conceito crucial aqui é apenas o carácter de dupla ligação parcial. Se s-cis e s-trans não fazem sentido para você depois de pensar sobre isso por um pouco, está tudo bem., Não é crucial para o resto da discussão.
consequências da conjugação (3): a reactividade de um sistema conjugado é frequentemente revelada pela sua “segunda melhor” forma de ressonância
mostramos o efeito que a conjugação (e, por extensão, a ressonância) tem nos comprimentos das ligações.
let’s take a closer look at its effect on electron density, which ultimately influences reactivity.para fins ilustrativos, vamos continuar a olhar para os alcenos.
a reatividade de um alceno pode ser modificada dramaticamente através da fixação de vários grupos.,
olhar para a “segunda melhor” forma de ressonância quando anexamos um doador pi como N(CH3) 2 a um alceno. Isto resulta em uma acumulação de carga negativa (δ -) nO carbono terminal do alceno, com o resultado que este alceno (que chamamos de enamina) é um excelente nucleófilo. Para tomar apenas um exemplo proeminente, as enaminas reagem com haletos de alquilo (como CH3I) e outros eletrófilos em uma classe de reações por vezes referidas como reações de Enamina de cegonha após seu descobridor, Cegonha Gilbert. Alcenos comuns como 2-buteno (abaixo) não funcionam nesta reação.,
fixação de um aceitador de pi tal como C=O resulta numa acumulação de carga positiva (δ+) sobre o carbono terminal do alceno, com o resultado de que esta espécie (a que chamamos um aldeído α, β insaturado, Michael acceptor, ou enone) é um excelente eletrófilo. α, β carbonilos insaturados reagem com nucleófilos (como CH3S–) e muitas outras classes de nucleófilos em um tipo geral de reação que chamamos de adições conjugadas ou às vezes reações de Michael.,
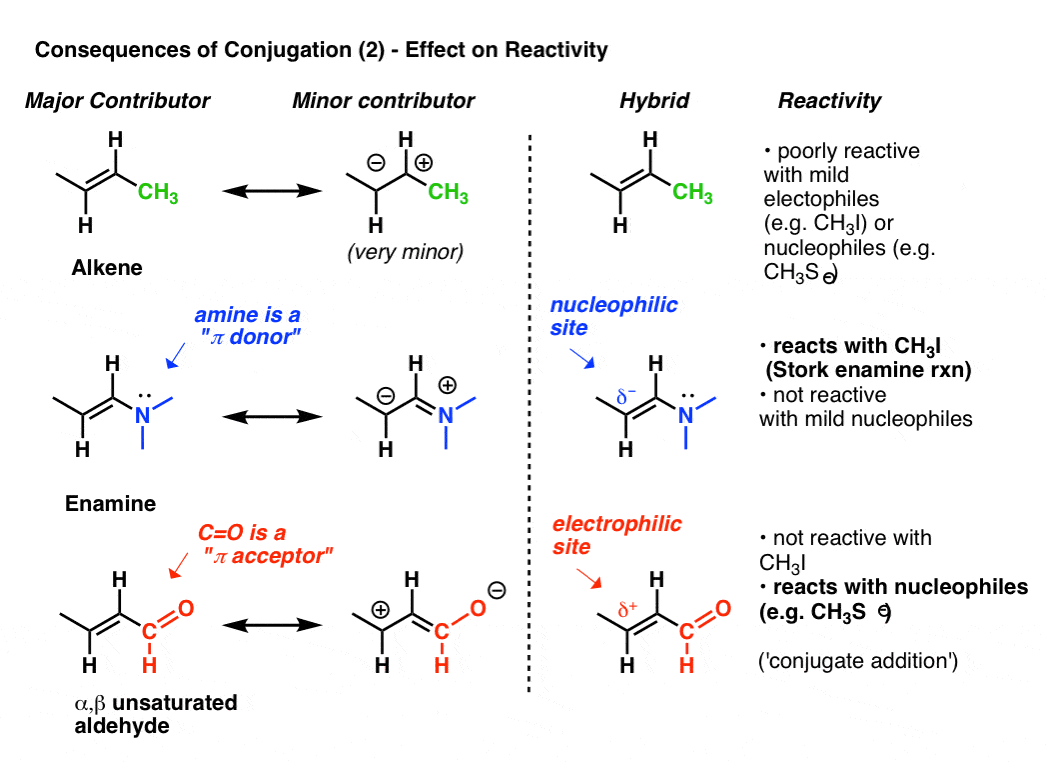
Esta é apenas a ponta do iceberg sobre como a conjugação pode afetar a reatividade, mas é suficiente para hoje.9., Orbital Sobreposição (Todos os p-Orbitais No Mesmo Plano) É Necessária Para a Conjugação (E Ressonância)
até agora vimos que:
- sobreposição entre os orbitais p é necessária para formar pi obrigações
- alguns único “títulos” podem ter “pi personagem bond”, devido à contribuição de um menor ressonância formulário (como amidas, por exemplo)
Aqui é a conseqüência lógica dessas duas declarações:
- para conjugação de existir, e, portanto, para que a ressonância ocorre, todos os orbitais p têm de sobrepor-se. Devem, portanto, estar todos alinhados no mesmo plano.,lembra-se da “catação Alila” que é “estabilizada por ressonância”? Para que a carbocação ganhe esta “estabilização de ressonância”, o orbital p vazio na carbocação deve ser alinhado com a ligação pi adjacente.se o orbital p está em um ângulo de 90 graus em relação aos orbitais p na ligação pi, não há conjugação e, portanto, não há estabilização de ressonância.
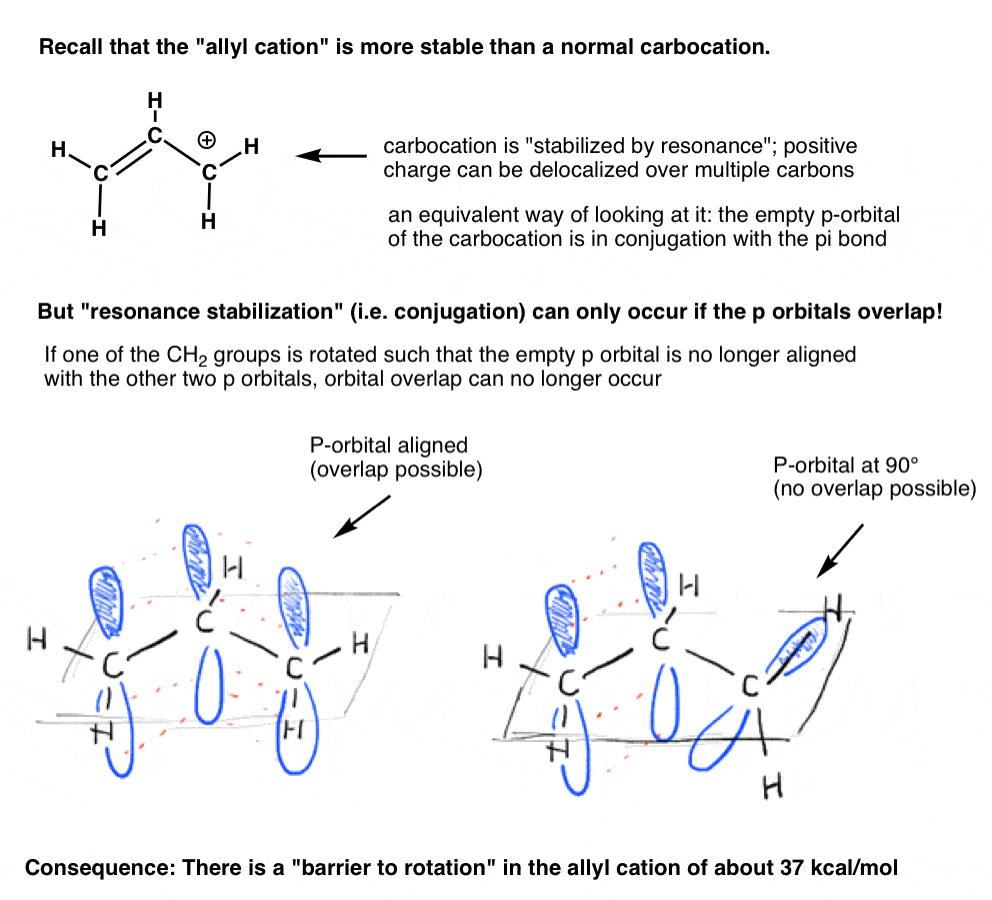
Como podemos prever, há uma barreira à rotação no cátion alilo, assim como há uma barreira à rotação em um alqueno., A barreira à rotação no catião alilo é de cerca de 37 kcal / mol-um pouco mais de metade da força de uma ligação pi C-C.
também vimos que a ligação C-N em Amidas tem um carácter parcial de ligação dupla, com uma barreira à rotação de cerca de 15-20 kcal/mol.
da mesma forma, este caráter de “ligação dupla parcial” só é possível se a orbital p contendo o par solitário for capaz de se sobrepor com os orbitais p compreendendo a ligação C=o pi.,
o carácter parcial da ligação dupla da ligação C-N em Amidas tem sido pensado para ser a principal razão pela qual eles são muito mais resistentes à quebra do que, digamos, ésteres . Uma vez que as proteínas do nosso corpo são unidas por ligações peptídicas (amida), esta é uma questão de grande importância! Formas de vida baseadas em ligações ester em vez de amida seriam muito mais frágeis!,amidas de cabeça de Ponte não são conjugadas, e são muito mais facilmente quebradas do que Amidas “ordinárias”
amidas de cabeça de Ponte dão uma ilustração do que acontece com amidas quando a sobreposição é impossível.assim como vimos em alcenos de cabeça de ponte, em amidas de cabeça de ponte, a sobreposição orbital entre o par solitário de nitrogênio e carbono carbonila é impossível devido à torção. O resultado é que a ligação C-N não tem caráter de ligação dupla parcial e é muito mais fácil de quebrar do que uma amida “normal”.
a amida de cabeça de Ponte abaixo é “quinuclidona”, uma amida retorcida que escapou à síntese durante décadas., Foi apenas em 2006 que foi finalmente feito (como seu ácido conjugado) através de uma rota inteligente pelo laboratório de Brian Stoltz na Caltech.
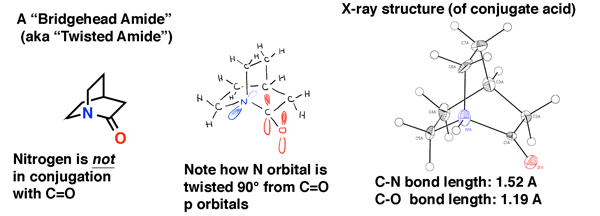
a estrutura do cristal de raios X testemunha a falta de conjugação neste amida. O comprimento da ligação C-N é 1,52 Å (típico de uma única ligação C-N) e o comprimento da ligação C=O é 1,19 Å, o que é típico de um comprimento da ligação em um aldeído ou cetona (1,20 Å). Esperamos, portanto, que seja um pouco mais instável para um ataque nucleofílico do que um amida normal, o que foi confirmado no estudo do Laboratório Stoltz.,
mais consequências da conjugação: cor e Cicloadições
até agora, este post tem sido uma revisão dos conceitos do 1º semestre. Não há nada na discussão acima que não possa ser razoavelmente explicado pelo que já aprendemos sobre conjugação e ressonância.no entanto, esta abordagem simplista só nos pode levar até aqui.
dois exemplos rápidos, porque este post já foi longo o suficiente.,
primeiro: conjugação e cor
Se você viu este post sobre como a lixívia funciona, você aprendeu que à medida que aumentamos o comprimento de conjugação, nós mudamos o comprimento de onda no qual as moléculas absorvem a luz. Algumas moléculas muito coloridas, como o caroteno, a clorofila e o licopeno, têm ligações duplas conjugadas muito longas.por exemplo, o licopeno é responsável pela cor vermelha dos tomates. Se removermos os laços duplos, removemos a cor. Por quê?
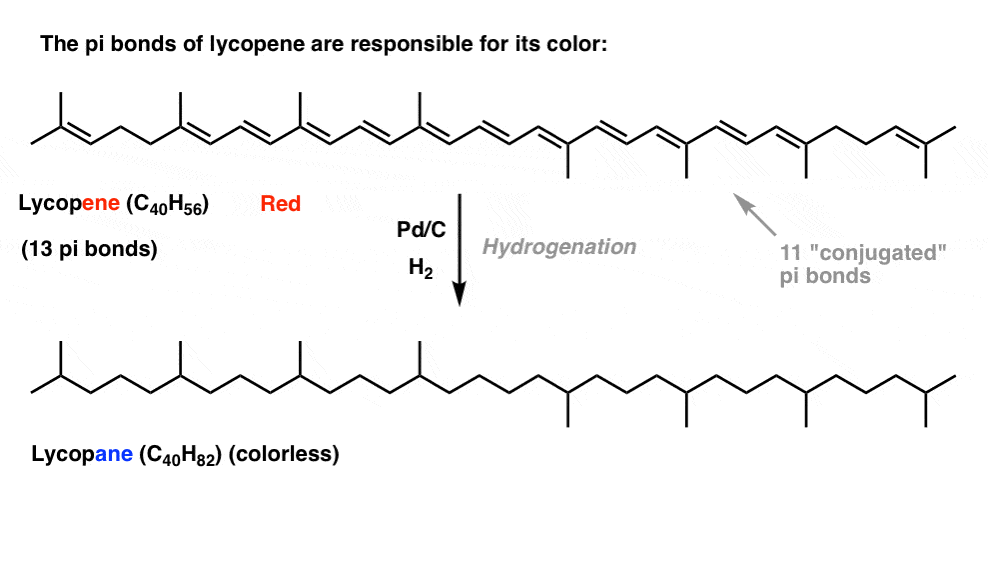
Qual é a relação entre a cor e a conjugação?, Porque é que o número de títulos duplos influenciaria esta situação? A ressonância não ilumina este assunto.
segundo: reações de dienos que formam anéis
Aqui estão algumas reações estranhas para você.se tratar o butadieno com a molécula à sua direita (maleato de metilo) obtém um novo produto contendo um anel com seis membros. Nada do que vimos até agora nos prepara para este tipo de reação, que é chamada de “cicloadição”.curiosamente, se tratar o eteno com a mesma molécula, nada acontece (excepto se o tratar com luz UV., Então você recebe um anel de quatro membros, mas eu divido). porquê?
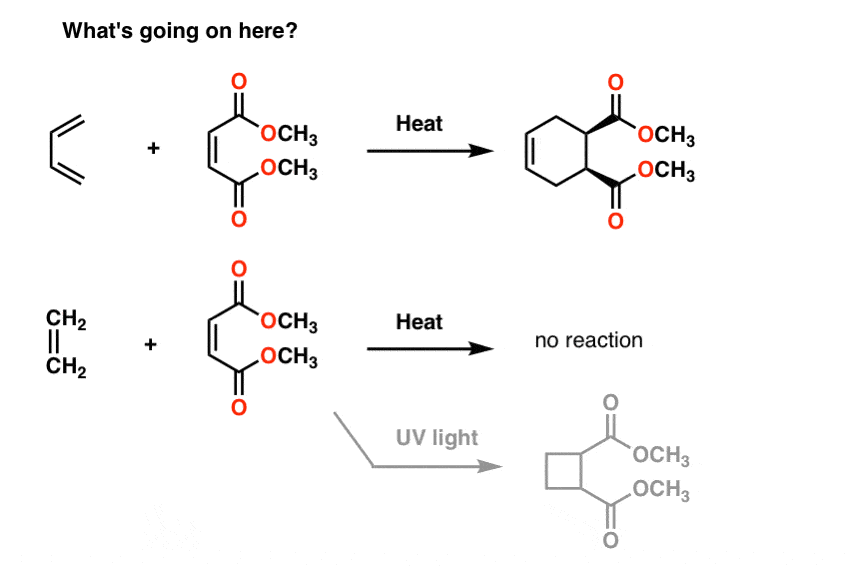
a ressonância também não nos ajuda aqui.
Next Up: Molecular Orbital Theory
What will help us answer these questions, as well as many others going forward is a concept called molecular orbital theory.
nos seguintes posts desta série, vamos cavar mais profundamente em como os orbitais p se sobrepõem para formar orbitais moleculares, e vamos examinar os níveis de energia desses orbitais., Também veremos como isso influencia a reatividade das moléculas e nos permite fazer previsões sobre seu comportamento químico.como veremos, a teoria orbital molecular fornece-nos um conjunto muito poderoso de conceitos que nos ajudarão a compreender a reactividade química a um nível muito mais profundo.graças a Tom Struble por toda a sua ajuda com este post.
notas
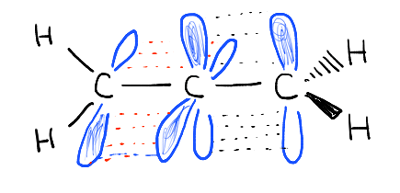
a-1,2 estirpe é a razão pela qual o tetra-terc-butiletileno ainda não foi sintetizado.as ligações pi não são conjugadas. Olha para os orbitais que compõem as duas ligações pi., Eles estão em ângulos retos um para o outro e não podem se sobrepor.
Usando NMR, espectroscopia de ressonância magnética nuclear. Estes isômeros conformacionais são às vezes chamados de “isômeros rotacionais” ou “rotamers” e podem complicar consideravelmente os espectros NMR. Os picos geralmente podem ser feitos à coalesce aquecendo a sonda de amostra.
isto está em contraste com, por exemplo, diferentes formas de cadeira de ciclo-hexano, que geralmente ainda pode interconverter à temperatura ambiente e coalesce a um único PICO., No entanto, se você arrefecer um ciclo-hexano substituído o suficiente, você pode “congelar” os diferentes conformadores e observá-los separadamente.




