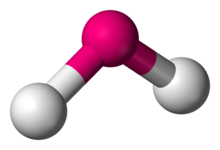
In chemistry, molecules with a non-collinear arrangement of two adjacent bonds have bent molecular geometry. Certos átomos, como o oxigênio, quase sempre ajustam suas duas (ou mais) ligações covalentes em direções não-colineares devido à sua configuração eletrônica. Água (H2O) é um exemplo de uma molécula dobrada, bem como seus análogos. O ângulo de ligação entre os dois átomos de hidrogênio é aproximadamente 104,45°., Geometria não-linear é comumente observada para outras moléculas triatômicas e íons contendo apenas elementos do grupo principal, exemplos proeminentes são dióxido de nitrogênio (NO2), dicloreto de enxofre (SCl2), e metileno (CH2).,
H2O, SO2
C2v
90°<θ<120°
>0

Oxigênio difluoride, um exemplo de uma molécula com o dobrado coordenação de geometria.,
Esta geometria é quase sempre consistente com a teoria VSEPR, o que geralmente explica a não colinearidade dos átomos com presença de pares solitários. Existem várias variantes de flexão, onde a mais comum é AX2E2, onde duas ligações covalentes e dois pares solitários do átomo central (A) formam uma concha completa de 8 elétrons. Eles têm ângulos centrais de 104° a 109,5°, onde este último é consistente com uma teoria simplista que prevê a simetria tetraédrica de quatro orbitais hibridizados sp3., Os ângulos reais mais comuns são 105°, 107°, e 109°: eles variam por causa das diferentes propriedades dos átomos periféricos (X).outros casos também experimentam hibridação orbital, mas em graus diferentes. As moléculas AX2E1, como a SnCl2, têm apenas um par solitário e o ângulo central cerca de 120° (o centro e dois vértices de um triângulo equilátero). Eles têm três orbitais sp2. Existem também compostos SD-hibridizados AX2 de metais de transição sem pares solitários: eles têm o ângulo central cerca de 90° e também são classificados como bent.




