
Jabones son agentes de limpieza que se hace generalmente a través de la reacción álcali (por ejemplo, hidróxido de sodio) que ocurren naturalmente la grasa o ácidos grasos. La reacción Produce sales de sodio de estos ácidos grasos, que mejoran el proceso de limpieza al hacer que el agua sea más capaz de eliminar las manchas de grasa de la piel, el cabello, la ropa y casi cualquier otra cosa., Como una sustancia que ha ayudado a limpiar los cuerpos, así como las posesiones, el jabón ha sido muy útil.
historia del jabón
El descubrimiento del jabón es anterior a la historia registrada, remontándose quizás hasta seis mil años atrás. Las excavaciones de la antigua Babilonia descubrieron cilindros con inscripciones para hacer jabón alrededor del 2800 A. C.registros posteriores del antiguo Egipto (c. 1500 A. C.) describen cómo los aceites animales y vegetales se combinaban con sales alcalinas para hacer jabón.
según la leyenda Romana, el jabón recibió su nombre del Monte Sapo, donde se sacrificaban animales., La lluvia lavaba la grasa de los animales sacrificados junto con las cenizas de madera alcalinas de los fuegos de sacrificio en el río Tíber, donde la gente encontró que la mezcla ayudaba a limpiar la ropa. Esta receta para hacer jabón fue relativamente sin cambios durante siglos, con los colonos estadounidenses recolectando y cocinando sebo animal (grasa extraída) y luego mezclándolo con una solución de potasa alcalina obtenida de las cenizas de madera dura acumuladas de sus incendios de invierno. Del mismo modo, los europeos hicieron algo conocido como jabón de Castilla con aceite de oliva., Solo desde mediados del siglo XIX se ha comercializado el proceso y el jabón se ha vuelto ampliamente disponible en el mercado local.
Química de Jabón
La estructura básica de todos los jabones es esencialmente la misma, que consiste en una larga hidrofóbico (agua-temiendo) de hidrocarburos «cola» y un hidrófilo (waterloving) aniónicos «cabeza»:
CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 COO − o CH 3 (CH 2 ) n − COO
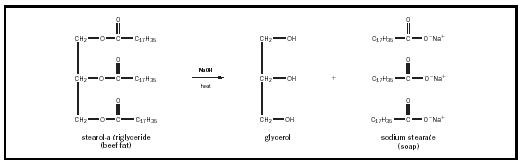
La longitud de la cadena de hidrocarburos («n») varía con el tipo de grasa o aceite, pero suele ser bastante largo., La carga aniónica en la cabeza de carboxilato generalmente se equilibra con un catión de potasio (K + ) o sodio (Na + ) cargado positivamente. En la fabricación de jabón, los triglicéridos en grasas o aceites se calientan en presencia de una base alcalina fuerte como el hidróxido de sodio, produciendo tres moléculas de jabón por cada molécula de glicerol. Este proceso se denomina saponificación y se ilustra en la Figura 1.
al igual que los detergentes sintéticos, los jabones son sustancias «tensoactivas» (surfactantes ) y, como tales, hacen que el agua sea mejor para limpiar superficies., El agua, aunque es un buen solvente general, desafortunadamente también es una sustancia con una tensión superficial muy alta. Debido a esto, las moléculas de agua generalmente prefieren permanecer juntas en lugar de mojar otras superficies. Los surfactantes funcionan reduciendo la tensión superficial del agua, permitiendo que las moléculas de agua mojen mejor la superficie y, por lo tanto, aumentan la capacidad del agua para disolver las manchas sucias y aceitosas.
al estudiar cómo funciona el jabón, es útil considerar una regla general de la naturaleza: «como se disuelve como.,»Las colas hidrofóbicas no polares del jabón son lipofílicas («amantes del aceite») y por lo tanto se incrustarán en la grasa y los aceites que ayudan a que la suciedad y las manchas se adhieran a las superficies. Las cabezas hidrofílicas, sin embargo, permanecen rodeadas por las moléculas de agua a las que son atraídas. A medida que más y más moléculas de jabón se incrustan en una mancha grasa, eventualmente rodean y aíslan pequeñas partículas de la grasa y forman estructuras llamadas micelas que se levantan en solución., En una micela, las colas de las moléculas de jabón están orientadas hacia y dentro de la grasa, mientras que las cabezas se dirigen hacia el agua, lo que resulta en una emulsión de partículas de grasa jabonosa suspendidas en el agua.
con agitación, las micelas se dispersan en el agua y se eliminan de la superficie previamente sucia. En esencia, las moléculas de jabón disuelven parcialmente la mancha grasa para formar la emulsión que se mantiene suspendida en agua hasta que se pueda enjuagar (ver Figura 2).
por buenos que sean los jabones, no son perfectos., Por ejemplo, no funcionan bien en agua dura que contiene iones de calcio y magnesio, porque las sales de calcio y magnesio del jabón son insolubles; tienden a unirse a los iones de calcio y magnesio, precipitando y cayendo de la solución. Al hacerlo, los jabones ensucian las superficies para las que fueron diseñados. Por lo tanto, los jabones han sido reemplazados en gran medida en soluciones de limpieza modernas por detergentes sintéticos que tienen un grupo sulfonato (R-SO 3 − ) en lugar de la cabeza de carboxilato (R-COO − )., Los detergentes de sulfonato tienden a no precipitar con iones de calcio o magnesio y generalmente son más solubles en agua.
usos del jabón
aunque la popularidad del jabón ha disminuido debido a los detergentes superiores, uno de los principales usos del sebo animal sigue siendo para hacer jabón, al igual que en años anteriores. Más allá de su capacidad de limpieza, el jabón se ha utilizado en otras aplicaciones. Por ejemplo, ciertos jabones se pueden mezclar con gasolina para producir napalm gelatinoso, una sustancia que se quema más lentamente que la gasolina pura cuando se enciende o explota en la guerra., Los jabones también se utilizan en «calor enlatado», una mezcla comercializada de jabón y alcohol que se puede encender y usar para cocinar alimentos o proporcionar calor. En general, el jabón es una sustancia notablemente útil, al igual que lo ha sido durante miles de años.




