
Saponi detergenti che di solito sono fatti dalla reazione alcali (ad esempio, idrossido di sodio) con grasso naturale o acidi grassi. La reazione produce sali di sodio di questi acidi grassi, che migliorano il processo di pulizia rendendo l’acqua meglio in grado di sollevare le macchie di grasso da pelle, capelli, vestiti e qualsiasi altra cosa., Come sostanza che ha aiutato a pulire i corpi e i beni, il sapone è stato notevolmente utile.
Storia del sapone
La scoperta del sapone precede la storia registrata, risalendo forse fino a seimila anni. Intorno al 2800 a. E.V. gli scavi dell’antica Babilonia scoprirono cilindri con iscrizioni per fare il sapone. Documenti successivi dell’antico Egitto (1500 a. E. V. circa ) descrivono come gli oli animali e vegetali venivano combinati con sali alcalini per fare il sapone.
Secondo la leggenda romana, il sapone prese il nome dal Monte Sapo, dove venivano sacrificati gli animali., La pioggia lavava il grasso dagli animali sacrificati insieme alle ceneri di legno alcaline dei fuochi sacrificali nel fiume Tevere, dove la gente trovava che la miscela aiutava a pulire i vestiti. Questa ricetta per fare il sapone era relativamente invariata per secoli, con i coloni americani che raccoglievano e cuocevano il sego animale (grasso reso) e poi lo mescolavano con una soluzione di potassio alcalino ottenuta dalle ceneri di legno duro accumulate dai loro incendi invernali. Allo stesso modo, gli europei hanno fatto qualcosa di noto come sapone di castiglia usando l’olio d’oliva., Solo dalla metà del diciannovesimo secolo il processo è stato commercializzato e il sapone è diventato ampiamente disponibile sul mercato locale.
Chimica del sapone
La struttura di base di tutti i saponi è essenzialmente la stessa, costituita da una lunga “coda” idrocarburica idrofoba (temuta dall’acqua) e da una “testa” anionica idrofila (waterloving):
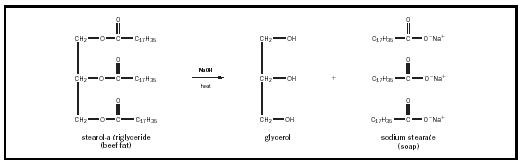
CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH catena idrocarburica (“n”) varia con il tipo di grasso o olio, ma di solito è piuttosto lungo., La carica anionica sulla testa di carbossilato è solitamente bilanciata da un catione di potassio (K + ) o sodio (Na + ) caricato positivamente. Nel fare il sapone, i trigliceridi nel grasso o negli oli vengono riscaldati in presenza di una forte base alcalina come l’idrossido di sodio, producendo tre molecole di sapone per ogni molecola di glicerolo. Questo processo è chiamato saponificazione ed è illustrato nella Figura 1.
Come i detergenti sintetici, i saponi sono sostanze “tensioattive” (tensioattivi ) e come tali rendono l’acqua migliore nella pulizia delle superfici., L’acqua, sebbene sia un buon solvente generale, è purtroppo anche una sostanza con una tensione superficiale molto elevata. Per questo motivo, le molecole d’acqua generalmente preferiscono stare insieme piuttosto che bagnare altre superfici. I tensioattivi agiscono riducendo la tensione superficiale dell’acqua, consentendo alle molecole d’acqua di bagnare meglio la superficie e quindi aumentare la capacità dell’acqua di sciogliere macchie sporche e oleose.
Nello studio di come funziona il sapone, è utile considerare una regola generale della natura: “come si dissolve come.,”Le code idrofobiche non polari del sapone sono lipofile (“amanti dell’olio”) e quindi si incorporano nel grasso e negli oli che aiutano lo sporco e le macchie ad aderire alle superfici. Le teste idrofile, tuttavia, rimangono circondate dalle molecole d’acqua a cui sono attratte. Man mano che sempre più molecole di sapone si incorporano in una macchia grassa, alla fine circondano e isolano piccole particelle di grasso e formano strutture chiamate micelle che vengono sollevate in soluzione., In una micella, le code delle molecole di sapone sono orientate verso e nel grasso, mentre le teste sono rivolte verso l’esterno nell’acqua, risultando in un’emulsione di particelle di grasso saponate sospese nell’acqua.
Con agitazione, le micelle vengono disperse nell’acqua e rimosse dalla superficie precedentemente sporca. In sostanza, le molecole di sapone dissolvono parzialmente la macchia grassa per formare l’emulsione che viene mantenuta sospesa in acqua fino a quando non può essere risciacquata (vedi Figura 2).
Buono come saponi sono, non sono perfetti., Ad esempio, non funzionano bene in acqua dura contenente ioni di calcio e magnesio, perché i sali di calcio e magnesio del sapone sono insolubili; tendono a legarsi agli ioni di calcio e magnesio, eventualmente precipitando e cadendo dalla soluzione. In tal modo, saponi effettivamente sporco le superfici che sono stati progettati per pulire. Pertanto i saponi sono stati ampiamente sostituiti nelle moderne soluzioni di pulizia da detergenti sintetici che hanno un gruppo solfonato (R-SO 3 -) invece della testa carbossilata (R − COO -)., I detergenti solfonati tendono a non precipitare con ioni di calcio o magnesio e sono generalmente più solubili in acqua.
Usi del sapone
Sebbene la popolarità del sapone sia diminuita a causa di detergenti superiori, uno dei principali usi del sego animale è ancora per fare il sapone, proprio come lo era negli anni passati. Oltre alla sua capacità di pulizia, il sapone è stato utilizzato in altre applicazioni. Ad esempio, alcuni saponi possono essere mescolati con benzina per produrre napalm gelatinoso, una sostanza che brucia più lentamente della benzina pura quando viene accesa o esplosa in guerra., I saponi sono utilizzati anche in “calore in scatola”, una miscela commercializzata di sapone e alcol che può essere accesa e utilizzata per cucinare cibi o fornire calore. Nel complesso, il sapone è una sostanza straordinariamente utile, proprio come lo è stato per migliaia di anni.




