The chemical element rubidium is classed as an alkali metal. It was discovered in 1861 by Robert Bunsen and Gustav Kirchhoff.

Data Zone
| Classification: | Rubidium is an alkali metal |
| Color: | silvery-white |
| Atomic weight: | 85.,468 |
| State: | solid |
| Melting point: | 39.3 oC, 312.45 K |
| Boiling point: | 690 oC, 963 K |
| Electrons: | 37 |
| Protons: | 37 |
| Neutrons in most abundant isotope: | 48 |
| Electron shells: | 2,8,18,8,1 |
| Electron configuration: | 5s1 |
| Density @ 20oC: | 1.,53 g/cm3 |
Show more, including: Heats, Energies, Oxidation,
Reactions, Compounds, Radii, Conductivities
| Atomic volume: | 55.9 cm3/mol |
| Structure: | bcc: body-centered cubic |
| Hardness: | 0.3 mohs |
| Specific heat capacity | 0.363 J g-1 K-1 |
| Heat of fusion | 2.192 kJ mol-1 |
| Heat of atomization | 81 kJ mol-1 |
| Heat of vaporization | 72.,216 kJ mol-1 |
| 1st ionization energy | 403 kJ mol-1 |
| 2nd ionization energy | 2632.1 kJ mol-1 |
| 3rd ionization energy | 3859.4 kJ mol-1 |
| Electron affinity | 46.885 kJ mol-1 |
| Minimum oxidation number | 0 |
| Min. common oxidation no. | 0 |
| Maximum oxidation number | 1 |
| Max. common oxidation no. | 1 |
| Electronegativity (Pauling Scale) | 0.,82 |
| Volume di polarizzabilità | 47.,O, Rb2O2, Rb2O3, RbO2 (brown rubidium superoxide) |
| Hydride(s) | RbH |
| Chloride(s) | RbCl |
| Atomic radius | 248 pm |
| Ionic radius (1+ ion) | 166 pm |
| Ionic radius (2+ ion) | – |
| Ionic radius (3+ ion) | – |
| Ionic radius (1- ion) | – |
| Ionic radius (2- ion) | – |
| Ionic radius (3- ion) | – |
| Thermal conductivity | 58.,2 W m-1 K-1 |
| conducibilità Elettrica | 47.8 x 106 S m-1 |
| di Congelamento punto di Fusione: | 39.3 oC, 312.45 K |

Rubidio in un tubo di vetro. Immagine di Dennis S. K (1).
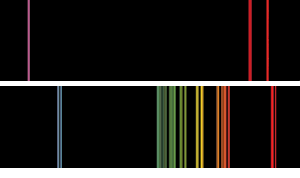
Spettri di emissione di fiamma di base del tipo che Bunsen e Kirchoff avrebbero potuto vedere. Lo spettro superiore è il potassio, con la caratteristica linea viola., Nel caso del rubidio, le linee rosse rubino gemelle più lontane nella parte rossa dello spettro di quanto Bunsen e Kirchoff avessero mai visto prima indicavano la presenza di un nuovo elemento.
Scoperta del rubidio
Il rubidio fu scoperto nel 1861, a Heidelberg, in Germania, da Robert Bunsen e Gustav Kirchhoff usando la spettroscopia, il metodo che la coppia aveva inventato e sviluppato nei due anni precedenti.,
Al centro dello spettroscopio si trovava un prisma di vetro, che divideva la luce proveniente da una fiamma in uno spettro – molto nello stesso modo in cui le gocce di pioggia possono dividere la luce solare in un arcobaleno. Lo spettroscopio ha ingrandito lo spettro per consentirne lo studio in dettaglio.
Quando Bunsen e Kirchhoff hanno posizionato diversi sali nella fiamma del bruciatore Bunsen recentemente inventato, hanno visto linee colorate in ciascuno degli spettri che hanno preso.
In modo eccitante, hanno scoperto che queste linee colorate erano uniche per qualsiasi sostanza fosse bruciata., Le linee in uno spettro erano un modo di’ impronte digitali ‘ un elemento.
Bunsen e Kirchoff avevano scoperto il cesio nel 1860 quando analizzarono lo spettro dell’acqua minerale.
Nel 1861 iniziarono a studiare il minerale lepidolite (un silicato di litio, potassio e alluminio) che era stato trovato in Sassonia, Germania. (2)
Bunsen e Kirchoff hanno usato l’acido idrocloroplatanico per precipitare il cloroplatinato di potassio dal minerale. Nel cloroplatinato di potassio hanno trovato un altro sale. (2,3)
Posizionando questo sale nel bruciatore Bunsen, hanno visto che il suo spettro conteneva molte nuove linee., Due di queste linee erano particolarmente eccezionali.
Nelle loro note Bunsen e Kirchoff hanno scritto: “Nessuna delle linee appartiene a un corpo precedentemente noto. Tra questi ce ne sono due che sono particolarmente notevoli nel trovarsi oltre la linea di Fraunhofer nella parte più esterna dello spettro solare rosso. Quindi proponiamo per questo nuovo metallo il nome rubidium (e il simbolo Rb) dal latino rubidius che è stato usato per esprimere il colore rosso più scuro.”(3)
Bunsen è stato in grado di estrarre il metallo rubidio dal suo sale cloruro per elettrolisi., Scoprì che il metallo era più elettropositivo del potassio e che l’acqua decomposta rilasciava idrogeno. (4)
La concentrazione di rubidio nella lepidolite era stata così piccola che Bunsen e Kirchoff avevano bisogno di elaborare 150 chilogrammi (330 lb) del minerale per estrarre abbastanza metallo per studiarne le proprietà. (2)
Il quartiere della tavola periodica del Rubidio
Il rubidio si comporta come un tipico metallo del Gruppo 1. È morbido e reagisce violentemente con l’acqua. Il rubidio segue il potassio nel gruppo 1, quindi le sue reazioni sono più violente di quelle del potassio. Il rubidio diventa liquido a 39,3 oC (102.,7 oF) – a little higher than your body temperature.
| Group 1 | Group 2 | Group 3 | |
| 4 | 19 K |
20 Ca |
21 Sc |
| 5 | 37 Rb |
38 Sr |
39 Y |
| 6 | 55 Cs |
56 Ba |
57 La |

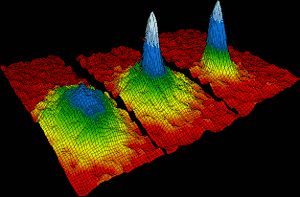
Gli atomi di rubidio si sono riuniti nel 1995 per formare il primo condensato di Bose-Einstein. Entro 170 miliardesimi di grado di zero assoluto, circa duemila singoli atomi di rubidio si sono riuniti per formare un singolo atomo gigante, che si è comportato come una singola specie. L’immagine a sinistra mostra la situazione prima della formazione della condensa. A destra, i colori bianco e blu mostrano l’alta densità dell’atomo gigante., Eric Cornell, Carl Wieman e Wolfgang Ketterle hanno vinto il Premio Nobel per la Fisica nel 2001 per i loro risultati nella produzione di condensati di Bose Einstein.
Aspetto e caratteristiche
Effetti nocivi:
Il rubidio non è noto per essere tossico.
Caratteristiche:
Il rubidio è un elemento metallico morbido, bianco-argenteo. È solido a temperatura ambiente ma si scioglie facilmente, a 39,3 oC.,
Come gli altri metalli del gruppo 1, il rubidio reagisce violentemente con l’acqua, formando idrossido di rubidio corrosivo (RbOH) e gas idrogeno, che viene acceso dal calore della reazione.
Il rubidio può anche accendersi spontaneamente nell’aria. Forma leghe con cesio, oro, sodio e potassio e forma amalgami con mercurio.
Il rubidio brucia con un colore di fiamma rosso-viola.
Usi del rubidio
Il rubidio viene utilizzato nelle fotocellule, come getter (remover of trace gas) nei tubi a vuoto e come fluido di lavoro nelle turbine a vapore.,
Il rubidio-87 è leggermente radioattivo ed è stato ampiamente utilizzato nella datazione delle rocce.
I composti di rubidio danno un colore viola nei fuochi d’artificio.
I sali di rubidio sono usati in bicchieri e ceramiche.
Abbondanza e Isotopi
Abbondanza sulla crosta terrestre: 90 parti per milione in peso, 21 parti per milione per talpe
Abbondanza sistema solare: 30 parti per miliardo, in peso, di 0,4 parti per miliardo dalle talpe
Costo, pure: $1200 per 100g
il Costo di massa: $ al 100g
Fonte: Il principale minerale di rubidio è lepidolite che contiene 1,5% di rubidio., Il rubidio è solitamente ottenuto come sottoprodotto della produzione di litio. Il metallo di rubidio può anche essere prodotto riducendo il cloruro di rubidio con il calcio.
Isotopi: il rubidio ha 29 isotopi le cui emivite sono note, con numeri di massa da 74 a 102. Il rubidio naturale è una miscela di due isotopi, 85Rb e 87Rb con abbondanze naturali rispettivamente del 72,2% e del 27,8%.,

Citare questa Pagina
Per la linea di collegamento, si prega di copiare e incollare uno dei seguenti:
<a href="https://www.chemicool.com/elements/rubidium.html">Rubidium</a>
o
<a href="https://www.chemicool.com/elements/rubidium.html">Rubidium Element Facts</a>
Per citare questa pagina accademica documento, si prega di utilizzare il seguente MLA conforme citazione:
"Rubidium." Chemicool Periodic Table. Chemicool.com. 18 Oct. 2012. Web. <https://www.chemicool.com/elements/rubidium.html>.




