Quali sono le concentrazioni ambientali di O2 e CO2?
Modalità lettore
Sappiamo tutti che l’aria che respiriamo è composta da 20% di ossigeno. La concentrazione di anidride carbonica ha recentemente superato i livelli di 400 parti per milione, il più alto in milioni di anni, pompato dalle attività umane. Questi gas atmosferici sono fondamentali per gli stili di vita di piante e animali. Tuttavia, le reazioni biologiche hanno luogo in mezzi liquidi e quindi dovrebbero dipendere dalla solubilità di questi costituenti inorganici chiave., Quali concentrazioni di ossigeno e anidride carbonica vedono le cellule nella loro vita quotidiana nei media acquosi in cui vivono?
Gli organismi viventi sono costruiti su quattro tipi principali di atomi: carbonio, ossigeno, azoto e idrogeno. Nel corpo umano, insieme ammontano a ≈96% del peso umido e ≈87% del peso secco come mostrato nella vignetta “Qual è la composizione elementare di una cellula?”. Tuttavia, il pool di questi costituenti nell’ambiente cellulare è spesso in quantità limitata. Ad esempio, come discuteremo di seguito l’ossigeno è solubile in acqua a solo circa 10 parti per milione., Nel caso del carbonio e dell’azoto, questi atomi sono legati in una forma inorganica relativamente inerte sequestrata rispettivamente in CO2 e N2. Di conseguenza, le cellule devono trovare il modo di estrarre queste molecole da questi serbatoi altrimenti inaccessibili e convertirle in una forma utilizzabile. Sebbene ” acqua” e “aria” siano noti a tutti nello stesso modo in cui chiunque viva nei climi settentrionali ha una risposta viscerale alla parola “neve”, spesso si dimentica che queste parole del volgare comune mascherano una ricca realtà molecolare.,
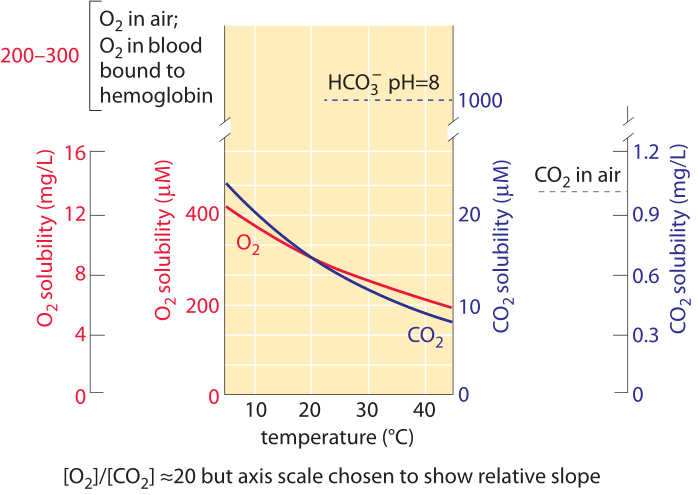
Figura 1: La solubilità di ossigeno e anidride carbonica in acqua e la loro dipendenza dalla temperatura nella composizione dell’aria normale. I valori dell’asse Y per i due gas sono stati scelti per consentire il confronto della variazione con la temperatura, ma si noti che la scala di concentrazione di ossigeno è 10 volte più grande. La concentrazione di ossigeno nell’aria è circa 500 volte superiore alla CO2, ma l’ossigeno è circa 50 volte meno solubile. Per entrambi i gas la concentrazione è inferiore a temperature più elevate., All’aumentare della temperatura, la disponibilità di CO2 diminuisce più velocemente di quella dell’ossigeno. Il bicarbonato (HCO3 -) è la forma inorganica più abbondante di carbonio nell’intervallo di pH 6-10. L’ossigeno nel sangue viene trasportato principalmente legato all’emoglobina ad una concentrazione simile a quella dell’ossigeno nell’aria. Questa concentrazione è circa 50 volte superiore a quella che verrebbe trasportata dal liquido sanguigno senza emoglobina. La trama si riferisce all’acqua dolce; la solubilità è di circa il 20-30% inferiore nell’acqua salata oceanica. Dati nelle curve calcolate dagli autori in base alla legge di Henry.,
Il carbonio entra nella biosfera quando viene trasformato dalla sua forma ossidata in CO2 a una forma ridotta principalmente nel motivo a ripetizione di carboidrati (CHOH)n. Questo motivo costituisce gli zuccheri in generale ed è il componente principale delle pareti cellulari presenti sia nei microbi che nelle piante che costituiscono la maggior parte della materia organica nella biosfera. Questa trasformazione avviene in un processo noto come fissazione del carbonio eseguito da piante, alghe e una serie di batteri noti come autotrofi., La concentrazione di CO2 disciolta in acqua all’equilibrio con l’atmosfera è ≈10 µM (BNID 108697) come mostrato in Figura 1. Ciò significa che ci sono solo circa 104 molecole di CO2 in un volume d’acqua delle dimensioni di un batterio. Questo dovrebbe essere paragonato ai 1010 atomi di carbonio che sono necessari per costituire un batterio. La concentrazione di O2 è allo stesso modo piuttosto bassa a ≈100-300 µM (BNID 109182 e vedere Figura 1 per apprezzare come questa solubilità cambia con la temperatura). La solubilità dell’ossigeno nell’acqua è circa 50 volte inferiore a quella della CO2., Di conseguenza, anche se l’ossigeno nell’aria è circa 500 volte più abbondante della CO2, il rapporto di concentrazione tra O2 e CO2 in soluzione è di circa 10 anziché 500. Per definizione, ogni mg/L in Figura 1 è una parte per milione in termini di massa, quindi la rarità di ossigeno e anidride carbonica può essere direttamente apprezzata osservando che la concentrazione di questi gas è nel dominio a una cifra in termini di mg / L e quindi anche solo pochissime parti per milione. CO2 ha la caratteristica aggiunta che reagisce con l’acqua per dare, a valori di pH fisiologicamente rilevanti, per lo più bicarbonato (HCO3–)., A pH 7 c’è circa 10 volte più carbonio inorganico sotto forma di bicarbonato rispetto alla CO2 disciolta. A pH 8, caratteristica dell’acqua oceanica, c’è 100 volte più bicarbonato della CO2 disciolta. Queste piscine sono di importanza per chiunque abbia lo scopo di misurare le piscine di carbonio inorganico a disposizione delle cellule. In particolare, il censimento di questi serbatoi molecolari è di importanza per comprendere il sequestro del carbonio negli oceani o il trasporto di carbonio inorganico nel nostro sangue dai tessuti ai polmoni., Il passaggio dalla CO2 al bicarbonato e viceversa è potenziato dall’azione dell’anidrasi carbonica. Questa transizione consente alla cellula di ricostituire il piccolo pool di CO2 rapidamente esaurito dal pool molto più grande di carbonio inorganico sotto forma di bicarbonato.
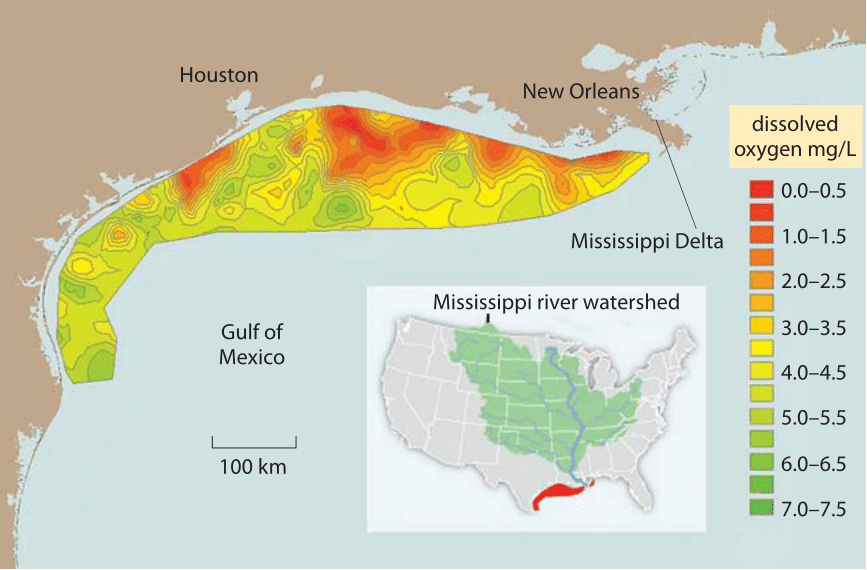
Figura 2: Zona morta nel Golfo del Messico a causa di fertilizzanti agricoli a carico del fiume Mississippi., La media a lungo termine per l’area di ipossia dell’acqua di fondo a metà estate (di colore rosso), dove i livelli di ossigeno disciolto <2 mg/L (aka zona morta, dove l’esaurimento dell’ossigeno porta al soffocamento dei pesci) è di 13.000 km quadrati, circa l’area del Connecticut. I valori riportano l’ossigeno misurato nelle stazioni di fondo del mare. Normale, vicino alla completa saturazione con (l’ossigeno si traduce in concentrazioni di circa 7-9 mg / L come mostrato in Figura 1. 1 mg / L è circa 1 parte per milione. I valori per altre parti del Golfo del Messico non vengono visualizzati perché non ci sono stazioni di misurazione situate lì., (Figura adattata da NOAA. http://service.ncddc.noaa.gov/rdn/www/media/hypoxia/maps/2011-hypoxia-contours.jpg http://www.ncddc.noaa.gov/hypoxia/products/ http://si.wsj.net/public/resources/images/NA-AZ768A_DEADZ_NS_20090817185740.jpg http://toxics.usgs.gov/hypoxia/hypoxic_zone.html)
In molti ambienti acquosi bassa solubilità e la lenta diffusione di O2 è una limitazione importante per il metabolismo aerobico di organismi. Ad esempio, si consideri il grave problema ambientale dell’eutrofizzazione, il processo per cui l’ossigeno si esaurisce quando quantità eccessive di fertilizzanti contenenti azoto e fosforo vengono lavate in un bacino d’acqua precedentemente limitato dai nutrienti, portando a fioriture di plancton., Quando il plancton successivamente affonda, la sua biomassa viene respirata da batteri che consumano ossigeno nel processo. L’apporto di ossigeno limitato si traduce in enormi zone morte nel Golfo del Messico, alcune grandi quanto l’area occupata dallo stato del Connecticut come mostrato nella Figura 2. Mentre la concentrazione di ossigeno può essere limitante per la respirazione in alcuni organismi, per quelli che eseguono la fissazione del carbonio può effettivamente essere troppo alta. Come notato nella Figura 1, c’è una dipendenza della solubilità dalla temperatura, tale che c’è relativamente meno CO2 rispetto a O2 a temperature più elevate., Questo è suggerito per guidare la pressione selettiva che porta alle piante C4 (ad esempio mais e canna da zucchero), che impiegano pompe metaboliche per aumentare localmente le concentrazioni di CO2 per la fissazione del carbonio.
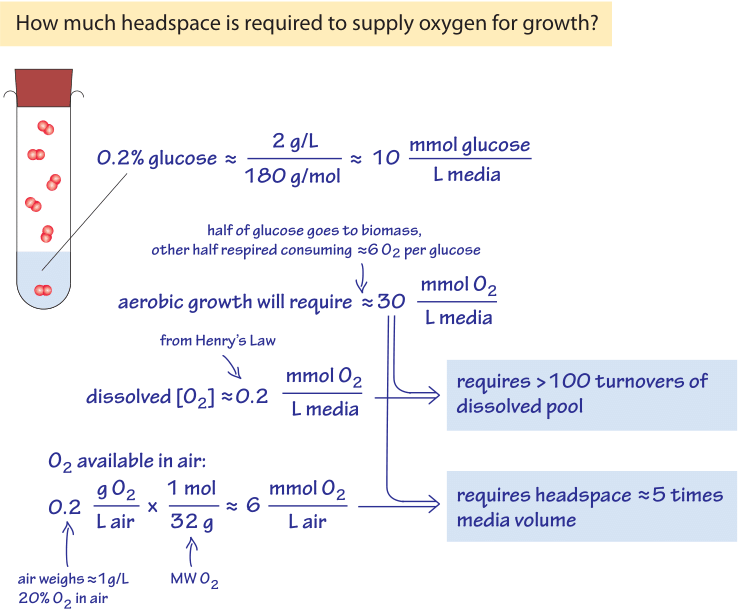
Figura 3: Calcolo del retro dell’involucro sulla disponibilità di ossigeno per la crescita nei mezzi liquidi & lo spazio di testa della camera di crescita riempito d’aria.
Per illustrare il significato delle basse concentrazioni di ossigeno presenti in ambienti marini in un contesto di laboratorio familiare, si pensi a una coltura notturna di batteri., Le cellule crescono da un piccolo numero di cellule alla saturazione a un OD600 di circa 1 (corrispondente a circa 100-1000 milioni di cellule batteriche per mL come discusso nella vignetta su ” Qual è la concentrazione di cellule batteriche in una coltura satura?”), in condizioni che possono in gran parte essere descritte come aerobiche. La crescita è facilitata da uno zucchero come il glucosio nei media (diciamo 0,2% in massa, equivalente a ≈10mM). Un semplice calcolo per quanto riguarda il fabbisogno di ossigeno di tale crescita è rappresentato schematicamente nella Figura 3., Come scenario di riferimento ragionevole, si consideri che circa la metà di questo zucchero sarà utilizzato per la costruzione di biomassa e l’altra metà per produrre energia (come evidenziato nell’osservazione che la resa di carbonio immagazzinato come biomassa dal carbonio prelevato dai terreni di crescita è solitamente ≈0.5, BNID 105318). La stechiometria del processo di respirazione è tale che per ogni molecola di glucosio vengono utilizzate 6 molecole di O2. Quindi, in un sistema chiuso, 5 mm di glucosio respirato per produrre energia richiederanno circa 30 mm di ossigeno., La concentrazione di ossigeno è stata notata sopra per essere nelle centinaia di µM, che è circa 100 volte inferiore. Possiamo quindi concludere come calcolato in Figura 3 che ci sarà bisogno di più di 100 cicli di rifornimento (turnover) del pool di ossigeno disciolto nei mezzi di crescita per fornire le esigenze di respirare il glucosio. Il rifornimento viene solitamente ottenuto mediante agitazione vigorosa, gorgogliamento o giranti speciali. Il mezzo di crescita è circondato da aria che ha una frazione di ossigeno del 20% equivalente a circa 10 µmol per litro (di aria)., Come analizzato in Figura 3, uno spazio di testa di un paio di volte il volume di coltura contiene abbastanza ossigeno per la crescita della coltura, finché l’aerazione è abbastanza vigorosa da dissolvere l’ossigeno dallo spazio di testa nel mezzo liquido. Come modo alternativo di pensare a questa stima, considera la regola empirica che la conversione del glucosio in biomassa batterica richiede circa 1 g di O2 per 1 g di peso secco cellulare prodotto (la maggior parte di esso emessa durante la respirazione come CO2)., Un OD600 di 1 ha circa 1 g di peso secco delle cellule per litro che richiederà 1 g di ossigeno, o 30 mmol, secondo la derivazione di cui sopra.
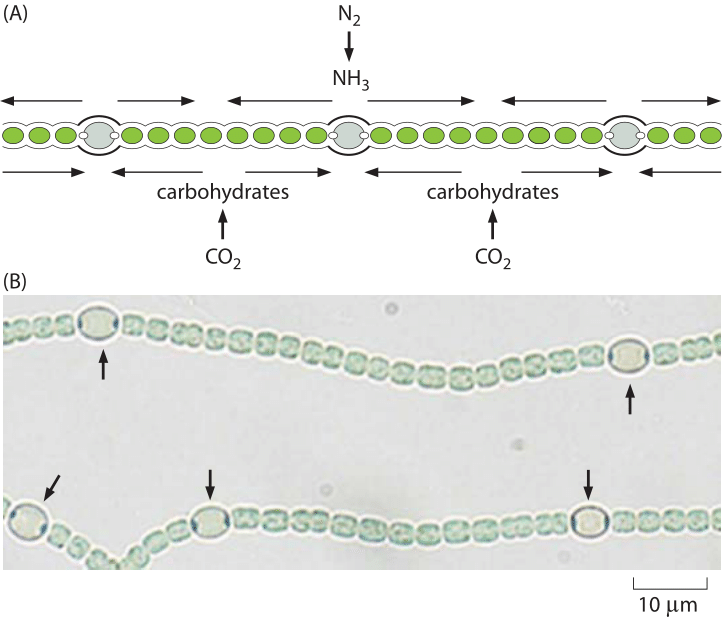
Figura 4: Eterocisti in Anabaena. (A) Schema che mostra il posizionamento regolare delle eterocisti in Anabaena che convertono dinitrogen in ammoniaca. (B) Immagini di microscopia che mostrano sia le cellule vegetative che le eterocisti (etichettate con le frecce). (Adattato dalla biologia fisica della cellula, 2a edizione., Garland Science, 2012)
L’ossigeno non è l’unico componente cellulare critico che è in offerta limitata. L’azoto, che comprende circa l ‘ 80% dell’atmosfera terrestre, è altamente inerte in quanto è quasi esclusivamente legato sotto forma di N2. Questo azoto è arrivato nell’atmosfera attraverso l’azione di batteri che utilizzano l’azoto come accettore di elettroni in un processo noto come denitrificazione (un altro esempio di come la biologia aiuta a modellare la terra). Per rendere nuovamente disponibile l’azoto atmosferico per la biochimica è necessario un processo impegnativo, cioè, trasformare l’azoto in ammonio (NH4+), nitrati (NO3–) o nitriti (NO2–). Gli organismi in grado di eseguire questo processo di fissazione dell’azoto sono organismi unicellulari come i partner simbiotici microbici trovati alle radici dei legumi. Solo un enzima è in grado di eseguire questo processo, vale a dire l’nitrogenasi. L’nitrogenasi è sensibile all’ossigeno che richiede quindi un ambiente locale privo di ossigeno, un fatto che porta alcuni sistemi microbici a sviluppare cellule specializzate note come eterocisti, come mostrato in Figura 4, che sono il sito di queste transazioni di azoto., Su scala globale, il ciclo naturale di fissazione dell’azoto è aumentato dall’umanità attraverso una quantità comparabile di azoto ridotto ottenuto nel processo industriale Haber-Bosch con conseguente fertilizzanti che sono essenziali per l’alimentazione di gran parte dell’umanità, ma che si traducono anche nell’eutrofizzazione ecologica sopra menzionata. Il fatto che gli esseri umani stiano apportando modifiche ai principali cicli biogeochimici che coinvolgono le piscine di queste sostanze inorganiche chiave ci avverte di pensare a ciò che è effettivamente un gigantesco esperimento gestito dall’uomo impegnato a alterare la biosfera.,









