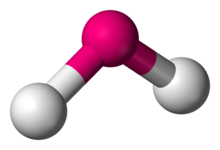
In chimica, le molecole con una disposizione non collineare di due legami adiacenti hanno geometria molecolare piegata. Alcuni atomi, come l’ossigeno, imposteranno quasi sempre i loro due (o più) legami covalenti in direzioni non collineari a causa della loro configurazione elettronica. L’acqua (H2O) è un esempio di una molecola piegata, così come i suoi analoghi. L’angolo di legame tra i due atomi di idrogeno è di circa 104,45°., La geometria non lineare è comunemente osservata per altre molecole triatomiche e ioni contenenti solo elementi del gruppo principale, esempi importanti sono il biossido di azoto (NO2), il dicloruro di zolfo (SCl2) e il metilene (CH2).,
H2O, SO2
C2v
90°<q<120°
>0

difluoruro di Ossigeno, un esempio di una molecola con l’inclinazione geometria di coordinazione.,
Questa geometria è quasi sempre coerente con la teoria VSEPR, che di solito spiega la non collinearità degli atomi con una presenza di coppie solitarie. Ci sono diverse varianti di flessione, dove il più comune è AX2E2 dove due legami covalenti e due coppie solitarie dell’atomo centrale (A) formano un guscio completo a 8 elettroni. Hanno angoli centrali da 104° a 109,5°, dove quest’ultimo è coerente con una teoria semplicistica che predice la simmetria tetraedrica di quattro orbitali ibridati sp3., Gli angoli reali più comuni sono 105°, 107° e 109°: variano a causa delle diverse proprietà degli atomi periferici (X).
Anche altri casi sperimentano l’ibridazione orbitale, ma in gradi diversi. Le molecole AX2E1, come SnCl2, hanno solo una coppia solitaria e l’angolo centrale di circa 120° (il centro e due vertici di un triangolo equilatero). Hanno tre orbitali sp2. Esistono anche composti AX2 ibridati sd di metalli di transizione senza coppie solitarie: hanno l’angolo centrale di circa 90° e sono anche classificati come piegati.




