Introduzione
Come recensito da Martin (1991) si possono trovare inversioni pericentriche nell’uomo in 1-2% della popolazione generale. Normalmente questi riarrangiamenti cromosomici bilanciati non causano alcun problema per il portatore, ma durante la meiosi c’è un certo rischio di formazione di loop di inversione che porta alla duplicazione de novo (ad esempio Malinverni et al., 2016), cancellazione (ad esempio Lacbawan et al.,, 1999) o una combinazione di entrambi nella prole (Tabella supplementare 1) quando si verifica un numero non uniforme di eventi di attraversamento all’interno del ciclo di inversione. Se quest’ultimo accade, questo è denominato come la formazione di un cromosoma ricombinante. Come spiegato da Morel et al. (2007) per la gametogenesi maschile: “un numero dispari di crossover all’interno del ciclo risulta in uno spermatozoo che porta il cromosoma normale, uno il cromosoma invertito e due ricombinanti con segmenti cromosomici duplicati e carenti, comprese le regioni distali all’inversione “., Inoltre, altri riarrangiamenti rari possono essere dovuti a un’inversione parentale, come un incrocio disuguale (Yang et al., 1997), U-loop-formazione (Ashley et al., 2007), rottura e riunione disuguale di cromatidi fratelli all’interno del ciclo di inversione (Phelan et al., 1993), o anche formazione di cromosomi ad anello (Hu et al., 2006). Inoltre, i ricombinanti sono stati osservati nei feti triploidi (Ekblom et al., 1993).
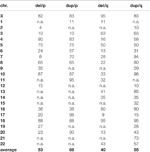
Tabella 1 Percentuale di regioni massimamente cancellate e duplicate per braccio cromosomico, compatibile con live.,
È stato originariamente suggerito che la prole vitale, ma mentalmente e fisicamente compromessa, può risultare solo se l’inversione include meno del 30% della lunghezza del cromosoma interessato (Martin, 1991). Prima, è stato proposto di determinare la possibilità di una prole squilibrata vitale misurando la percentuale di lunghezza autosomica aploide dei segmenti cromosomici distali rispetto ai punti di interruzione dell’inversione (Daniel, 1981). Più tardi, Morel et al., (2007) ha suggerito che non ricombinanti possono essere prodotte quando l’inverted segmento di dimensione <30%, un paio di ricombinanti quando invertito la dimensione del segmento è all’interno del 30-50% e un numero significativo sono prodotte quando le invertito la dimensione del segmento è >50% della lunghezza totale dell’interessato cromosoma. Tuttavia, sono stati trovati anche esempi di ricombinanti di dimensioni inferiori a 100 Mb (Malan et al., 2006) o famiglie numerose senza prole ricombinante non adatta a quelle regole suggerite (Van der Linden et al., 1975; Honeywell et al., 2012).,
Qui riportiamo due nuovi casi con inversione pericentrica e prole con cromosomi ricombinanti e forniamo una revisione complessiva di 210 casi di questo tipo {plus>100 casi con “sindrome del cromosoma 8 ricombinante” }. Questi dati comprendono anche i 56 casi esaminati nel 1997 da Ishii e colleghi. Come origine materna preferenziale dei cromosomi ricombinanti è stato già dimostrato da Ishii et al. (1997) questo non è stato ricapitolato nel presente studio., Effetti simili sono ben noti per piccoli cromosomi marker soprannumerari (Liehr 2006) e trasmissione di altri tipi di aberrazioni cromosomiche nell’uomo (Liehr et al., 2018). Per l’impatto clinico e l’impatto di inversioni paracentriche da grandi e piccole a submicroscopiche, quest’ultima parte della normale varianza nell’uomo, vedere Pettenati et al. (1995); Liehr et al. (2018) e database di varianti genomiche (http://dgv.tcag.ca/dgv/app/home).,
Materiale e metodi
I casi studiati
I casi inclusi qui sono stati identificati durante la diagnostica citogenetica di routine (molecolare) e sono stati forniti il consenso informato per la pubblicazione.
Famiglia 1: Qui una femmina sana ha avuto due bambini affetti con due partner maschi diversi. Il primo figlio, 17y, ha mostrato una leggera compromissione mentale, nanismo, ipoacusia neurosensoriale e dismorfismo facciale; il secondo figlio, 6y, aveva anche una leggera compromissione mentale, microcefalia, ipoacusia neurosensoriale, segni dismorfici. Campioni di sangue erano disponibili dalla madre e dai due bambini.,
Famiglia 2: le cellule ematiche e amnioniche di una donna incinta sana sono state studiate a causa di anomalie ecografiche rilevate durante la diagnostica di routine a 16 settimane di gestazione.
Test citogenetici molecolari
Il sangue e / o l’amnione di entrambe le famiglie sono stati sottoposti a coltura cellulare di routine o estrazione del DNA utilizzando procedure standard. La preparazione della metafase è stata eseguita secondo procedure standard e i cariotipi sono stati analizzati mediante G-banding a livello di banda ∼450., L’ibridazione in situ a fluorescenza (FISH) è stata effettuata utilizzando sonde per regioni subtelomeriche del cromosoma 18 (Abbott, Vysis, Wiesbaden, Germania), vernici cromosomiche parziali per lo stesso cromosoma (sonde fatte in casa di Liehr e Claussen, 2002) o una sonda di fascettatura multicolore impostata per il cromosoma 11 (Liehr et al., 2002). Array – comparative genomic ibridazione (aCGH) è stato fatto come riportato in precedenza (Coci et al., 2017).
Ricerca in letteratura
I casi nati e non nati con cromosomi ricombinanti sono stati messi insieme sulla base di Ishii et al., (1997); Schinzel (2001), e cerca in https://www.ncbi.nlm.nih.gov/pubmed e https://www.google.de/. Casi De novo o simili con origine parentale non chiarita non sono stati inclusi qui. Sicuramente i casi riportati solo su incontri genetici sono stati persi, in quanto questi non sono forniti sistematicamente da nessuna biblioteca non disponibile online.
Risultati
Casi studiati

Figura 1 Risultati di citogenetica molecolare eseguiti per le famiglie 1 e 2., Sul lato sinistro GTG – / invertito 4′, 6-diamidino-2-fenilindolo-banding risultato e PESCE risultato del corrispondente cromosoma normale e derivato è raffigurato. A destra sono mostrate raffigurazioni schematiche di cromosomi normali, invertiti e derivati/ricombinanti; i punti di interruzione sono evidenziati da punte di freccia. (A) cromosomi normali e derivati 18 di madre e figlio 1 dopo GTG-banding e PESCE sono visibili. Per i PESCI sono state utilizzate sonde subtelomeriche per 18pter (ST 18p) e 18qter (ST18q) e vernici cromosomiche parziali (pcps) per 18p e 18q., (B) cromosomi normali e derivati 11 della madre e del nascituro dopo 4’invertito,6-diamidino-2-fenilindolo-banding e PESCE sono visibili. Per i PESCI è stato utilizzato un set di sonde multicolor per bande cromosomiche-11specifiche-i risultati sono rappresentati in due diverse bande pseudocolor; quest’ultima doveva essere applicata, a causa delle diverse qualità di preparazione dei cromosomi derivati dal sangue e dall’amnione. Le punte di freccia evidenziano i punti di interruzione cromosomici.

Figura 2 Sintesi dell’indagine in letteratura (vedere Tabella supplementare 1)., Le regioni massime di guadagni o perdite terminali lungo ogni autosoma umano e il cromosoma X sono inserite come linee verticali verdi e rosse, ciascuna. I cromosomi sono ordinati in base al numero di casi segnalati con un cromosoma ricombinante corrispondente a causa di un’inversione pericentrica parentale—il numero cromosomico è dato come un grande nero e il numero di casi segnalati come un piccolo numero viola sotto ogni idiogramma.,
Ricerca letteraria
La ricerca letteraria ha rivelato complessivamente 210 famiglie / casi con cromosomi ricombinanti a causa di un’inversione pericentrica bilanciata ereditaria . Sono stati trovati esempi per tutti i cromosomi, a parte il cromosoma Y.
I cromosomi ricombinanti forniscono delezioni terminali e duplicazioni al genoma umano. Sulla base della tabella complementare 1, nella figura 2 è stato elaborato uno schema che evidenzia la compatibilità delle eliminazioni e delle duplicazioni dei terminali con i vivi umani.,
Discussione
Due nuovi casi di cromosomi ricombinanti (rec) sono stati aggiunti ai 210 casi comparabili ancora riportati , che sono tutti dovuti a un’inversione pericentrica parentale. In contrasto con la revisione di Ishii et al. dal 1997 ora ci sono esempi disponibili per tutti i cromosomi umani, a parte per il cromosoma Y. Tuttavia, i cromosomi rec(Y) dovrebbero essere possibili solo in caso di uomini con 2 cromosomi Y, uno con inversione pericentrica; e un tale istante non è stato ancora segnalato.,
È interessante notare che un principio ben noto delle varianti del numero di copia (CNV) può anche essere dedotto dalla Figura 2: i guadagni dei numeri di copia sono meglio compensabili dal genoma umano rispetto alle perdite; esempi sono le sindromi di microdelezione / microduplicazione o il fatto che solo le trisomie 13, 18 e 21 sono vitali ma non le monosomie di quei tre cromosomi (Weise et al., 2012). In questo studio (Figura 2) per praticamente tutti i cromosomi le regioni compatibili con live sono lager per guadagni che per perdite di numeri di copia (vedi anche Tabella 1).,
La frequenza osservata di ricombinanti è cromosoma-specifiche, così come le differenze riguardanti derivanti vitali ricombinante cromosomi sono diversi:
Cromosomi con più di 50 relazioni riassunti in questo studio:il Cromosoma 8 è l’unico con >100 casi segnalati e persino una OMIM numero per una sindrome causata da questo tipo di riarrangiamento. Molto probabilmente questo è dovuto ad un’alta frequenza di inv (8) (p23.1q22.1) nella popolazione ispanica negli Stati Uniti (Sujansky et al., 1993).,
– Cromosomi con più di 7-10 segnalazioni riassunte in questo studio:Casi che coinvolgono cromosomi 4 e 5 possono essere stati osservati più frequentemente a causa di studi citogenetici più dettagliati in pazienti con Wolf-Hirschhorn- (OMIM 194190) e Cri-du-Chat-sindrome (OMIM 123450), rispettivamente. I cromosomi 13, 18 e 21 sono i cromosomi umani più poveri del gene, quindi le eliminazioni parziali in essi sono più tollerabili rispetto ad altri autosomi., I cromosomi 7 e 11 sono alla base dell’imprinting e quindi sono anche collegati a noti disturbi dell’imprinting; pertanto, i pazienti con questi disturbi possono anche essere studiati più probabilmente in dettaglio rispetto ad altri. Le aberrazioni del cromosoma X possono portare a problemi di determinazione del sesso e / o infertilità—quindi anche tali aberrazioni hanno maggiori probabilità di essere rilevate rispetto ad altre (autosomiche)., Per i cromosomi 3 e 10 , dove i ricombinanti sono anche regolarmente osservati (Figura 2) questi due cromosomi hanno in alcune popolazioni che appaiono regolarmente grandi inversioni pericentriche, come riportato per il cromosoma 8 nella popolazione ispanica negli Stati Uniti.
– Cromosomi solo raramente osservati riassunti in questo studio: Tra i cromosomi rimanenti alcuni sono relativamente ricchi di geni (come i cromosomi 1 e 19) o acrocentrici (in cui le inversioni pericentriche sono piuttosto rare, chrs. 13,14, 15, 21 e 22).,
Oltre ai fattori ancora discussi che potenzialmente influenzano le frequenze dei cromosomi ricombinanti nella prole umana vitale, diversi tassi di ricombinazione e punti caldi di ricombinazione lungo ciascun cromosoma e in dipendenza della meiosi di genere sta attraversando come ben delineato da Bhatt et al. (2014) potrebbe anche avere un impatto qui.,
Secondo Gardner e Amor (2018) la formazione di cromosomi ricombinanti nei gameti dei portatori di inversione pericentrica è una funzione della dimensione dell’inversione: maggiore è l’inversione, più frequentemente i ricombinanti sono osservabili nei gameti. Inoltre, p-delezione/q-duplicazione – appaiono circa nelle stesse frequenze di q-delezione/p-duplicazione-ricombinanti. Tuttavia, come già suggerito dai dati di Ishii et al. (1997), la p-delezione/q-duplicazione è circa il doppio della frequenza di q-delezione/p-duplicazione in forme vitali di cromosomi ricombinanti., Considerando la differenza precedentemente discussa dei CNV, essendo presente come guadagni o come perdite, si dovrebbe considerare in generale un numero inferiore di geni sensibili al dosaggio nel braccio p dei cromosomi umani rispetto ai bracci Q.
Nel complesso, qui viene fornita una revisione aggiornata dei ricombinanti vitali basati sull’inversione pericentromerica., Considerando anche recenti nuove intuizioni sull’influenza dei riarrangiamenti cromosomici sull’architettura interfase (parola chiave: domini topologicamente associati = TADs) (Schrank e Gautier, 2019), nonché sulla sovrapposizione di breakpoint evolutivi conservati (importanti nella speciazione) e breakpoint osservati nei casi clinici (Liehr et al., 2011), viene evidenziata l’importanza delle aberrazioni citogenetiche grossolane per fornire una migliore comprensione dei principi generali del genoma umano.
Dichiarazione di disponibilità dei dati
I set di dati per questo studio possono essere richiesti agli autori.,
Dichiarazione etica
La revisione e l’approvazione etica non erano necessarie per lo studio su partecipanti umani in conformità con la legislazione locale e i requisiti istituzionali. I pazienti / partecipanti hanno fornito il loro consenso informato scritto a partecipare a questo studio.
Contributi dell’autore
TL ha redatto il documento e ha fatto la ricerca della letteratura. Ho fatto le analisi citogenetiche della famiglia 1. KM ha fatto le analisi aCGH della famiglia 1. MZ, NP e AA-R hanno fatto le analisi dei PESCI di entrambe le famiglie. KW ha fornito informazioni cliniche alla famiglia 1.,
Conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di rapporti commerciali o finanziari che potrebbero essere interpretati come un potenziale conflitto di interessi.
Riconoscimenti
Asta Cramer e Gabriele Hickmann (Essen, Germania) sono molto apprezzati per aver fornito family 2.
Materiale supplementare
Daniel, A. (1981). Differenze strutturali nelle inversioni pericentriche. Applicazione ad un modello di rischio di ricombinanti. Ronzio. Genet. 56, 321–328. doi: 10.,1007/BF00274687<| p>
PubMed Abstract | CrossRef Full Text/Google Scholar
Gardner, RJMcK, Amor, DJ (2018).Anomalie cromosomiche di Gardner e Sutherland e consulenza genetica. New York: Oxford Univeristy Press.
Google Scholar
Liehr, T. (2006). I piccoli cromosomi marcatore soprannumerari familiari sono ereditati prevalentemente attraverso la linea materna. Genet. Med. 8, 459–462. doi: 10.1097/00125817-200607000-00011
CrossRef Full Text / Google Scholar




