Coniugazione in chimica organica: definizione, esempi, esplorazione e conseguenze
Questo è il primo di una serie di post che alla fine coprirà la coniugazione, i sistemi pi, la teoria degli orbitali molecolari, i dieni, le aggiunte 1,2 e 1,4, la reazione di Diels Alder e altre reazioni pericicliche. Stiamo per iniziare rivedendo le basi!,Rivelato Dalla Sua “Second Best” Risonanza Forma
Rivisitare il Pi Bond (e Pi bonding): “di Lato” Orbitale Sovrapposizione Tra Adiacente p-Orbitali
Una delle prime cose che si impara a conoscere alcheni è che la rotazione intorno a C-C pi (π) il legame non si verifica., Ad esempio, a temperature e pressioni normali., trans-2-butene (mostrato sotto a sinistra) non è mai osservato per convertire spontaneamente in cis-2-butene (a destra) . Sono composti separabili, con diversi punti di fusione e di ebollizione. È possibile acquistare ciascuno di essi separatamente da Aldrich. Questo non sarebbe possibile se ci fosse una rotazione libera sul doppio legame.,
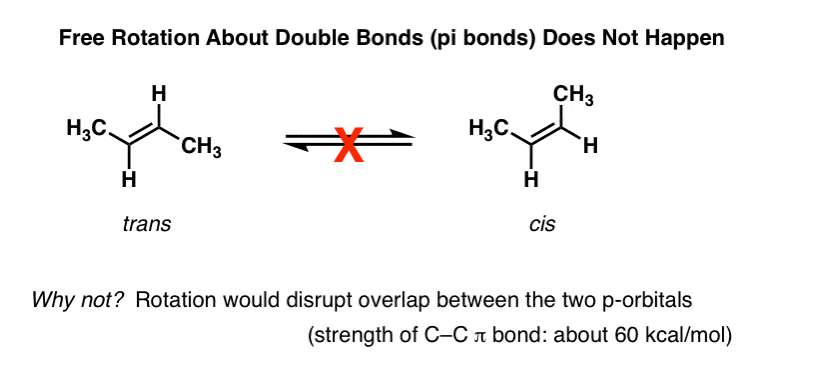
Scavando più a fondo in questo, abbiamo visto che ciò è dovuto a un fenomeno chiamato “legame pi” – una sovrapposizione laterale di due orbitali p adiacenti, ciascuno contenente un elettrone, che si traduce in un orientamento preferito in cui gli orbitali p “si allineano” l’uno accanto all’altro, come i soldati. A causa della geometria simile a un manubrio dell’orbitale p, la sovrapposizione non è possibile quando i due orbitali p sono a 90° l’uno dall’altro, il che rappresenta quella “barriera rotazionale”.,
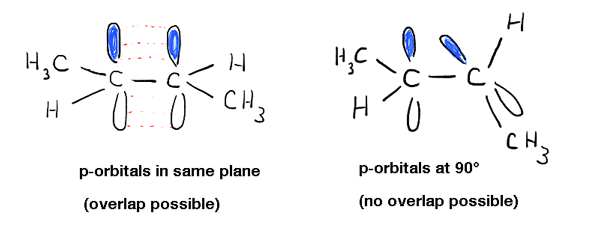
Questo ha altre conseguenze fisiche oltre alla barriera di rotazione: influenza anche la geometria molecolare. Poiché il legame Pi è un fenomeno esclusivo degli orbitali p, ciò significa che ogni legame pi a cui partecipa un atomo lascerà un orbitale p in meno disponibile per “ibridazione” con l’orbitale s sull’atomo. Ciò si traduce nella familiare geometria” trigonale planare “(sp2 ) per i carboni alchenici tipici e geometria” lineare ” (sp) per i carboni alchini.
Quindi, gli alcheni sono “piatti”, al contrario dei carboni alchilici, che adottano una geometria tetraedrica.,
L’importanza della sovrapposizione orbitale per il legame Pi
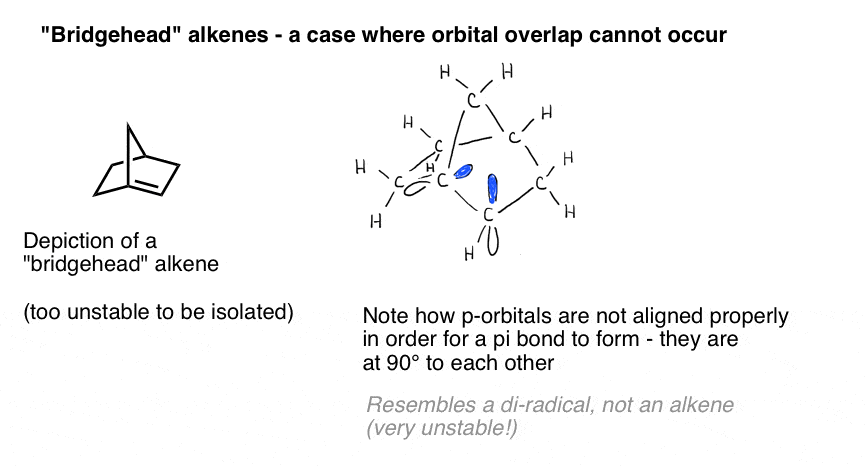
Una vivida illustrazione dell’importanza della sovrapposizione orbitale è presentata da un caso in cui potremmo ingenuamente pensare che un doppio legame “dovrebbe” formarsi – ma non lo fa. Bredt osservò nel 1924 che gli alcheni tendono a non formarsi su posizioni di “testa di ponte”, come nella molecola in basso a sinistra, un’osservazione che venne chiamata “regola di Bredt”.
Perché no? Se crei il modello, vedrai che la geometria dell’anello biciclico costringe quegli orbitali p ad essere orientati ad angolo retto. Non c’è sovrapposizione tra gli orbitali P., Pertanto, assomiglia a un carbonio con due radicali adiacenti più di quanto non faccia un vero legame pi!
I disegni tridimensionali su una superficie piana non rendono davvero giustizia alla gloria della struttura tridimensionale. Ecco un modello e il video di accompagnamento.
Quelle cose rosa dovrebbero essere gli orbitali P. Vedi come sono ad angolo retto l’uno con l’altro? Ciò significa che non si sovrappongono.
tramite GIPHY
La linea di fondo è che è necessario sovrapporsi tra gli orbitali p per formare un legame Pi., Nei sistemi aciclici generalmente non è un problema
3. Oltre i legami Pi: “Coniugazione” di 3 o più orbitali p
Nella chimica organica del primo semestre apprendiamo che questa sovrapposizione di orbitali p non è necessariamente limitata a due orbitali p adiacenti. La sovrapposizione può estendersi oltre due orbitali p per includere tre, quattro, cinque e ancora più orbitali p consecutivi su atomi consecutivi, costruendo “sistemi pi” più grandi (ad esempio il licopene).,
Vediamo anche che la definizione di “p orbitale “è alquanto flessibile e può includere esempi come
Chiamiamo questo” accumulo “di orbitali p in” sistemi pi “più grandi,”coniugazione”. In ciascuna delle molecole centrali sottostanti, l’alchene (legame pi) è coniugato con un orbitale p adiacente.
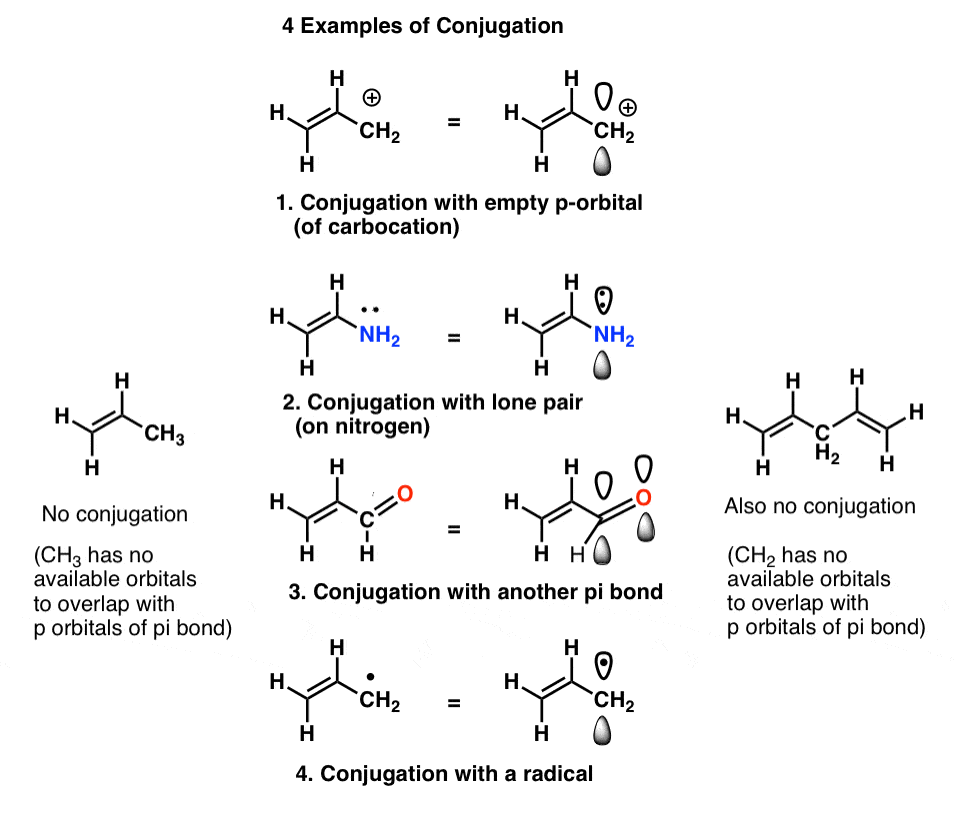
Il “killer di coniugazione” a cui prestare attenzione è un atomo privo di coppie solitarie collegate a soli legami singoli, come CH2 nell’esempio in basso a destra (1,4-pentadiene). Questi due legami pi non sono coniugati.
Ecco una divertente domanda trabocchetto., I doppi legami nella molecola sottostante (allene) sono coniugati? Perché o perché no?
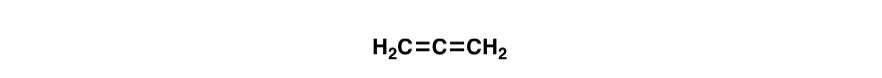
4. La distinzione tra coniugazione e risonanza
Si potrebbe chiedere: questo suona solo come risonanza. Qual è la differenza?
Prendiamo un secondo per distinguere la coniugazione e la risonanza.
- La coniugazione è ciò che chiamiamo quando 3 o più orbitali p si uniscono in un “sistema pi”più grande.,
- Questi sistemi pi coniugati contengono elettroni, che spesso chiamiamo “elettroni pi” per distinguerli dagli elettroni che comprendono singoli legami nella molecola.
- Le diverse disposizioni degli elettroni all’interno di quel “sistema pi” sono chiamate forme di risonanza.,
Un’analogia approssimativa potrebbe andare in questo modo:
- Pensa agli orbitali p come ad essere un po ‘ come “stanze” per elettroni (occupazione massima: 2)
- Unire più stanze insieme in un edificio più grande è coniugazione
- Le diverse disposizioni consentite di persone (elettroni) all’interno di quell’edificio sono forme di risonanza.
Il requisito chiave per la coniugazione è la sovrapposizione orbitale, che espanderemo tra un po’.
Per ora, esaminiamo alcune conseguenze della coniugazione.,
Conseguenze di Coniugazione (1): Lunghezze di Legame
Come ho appena detto, siamo più abituati a coniugazione nel contesto di “risonanza”, un concetto che abbiamo trattato prima (e dato che questa serie sta nel secondo semestre del territorio, è la pena di ri-familiarizzare con)
Per esempio, con lo ione acetato (CH3CO2)– e il catione allilico (mostrato di seguito), abbiamo visto che ci sono due modi diversi di organizzare la pi elettroni, che noi chiamiamo “forme risonanza”.,
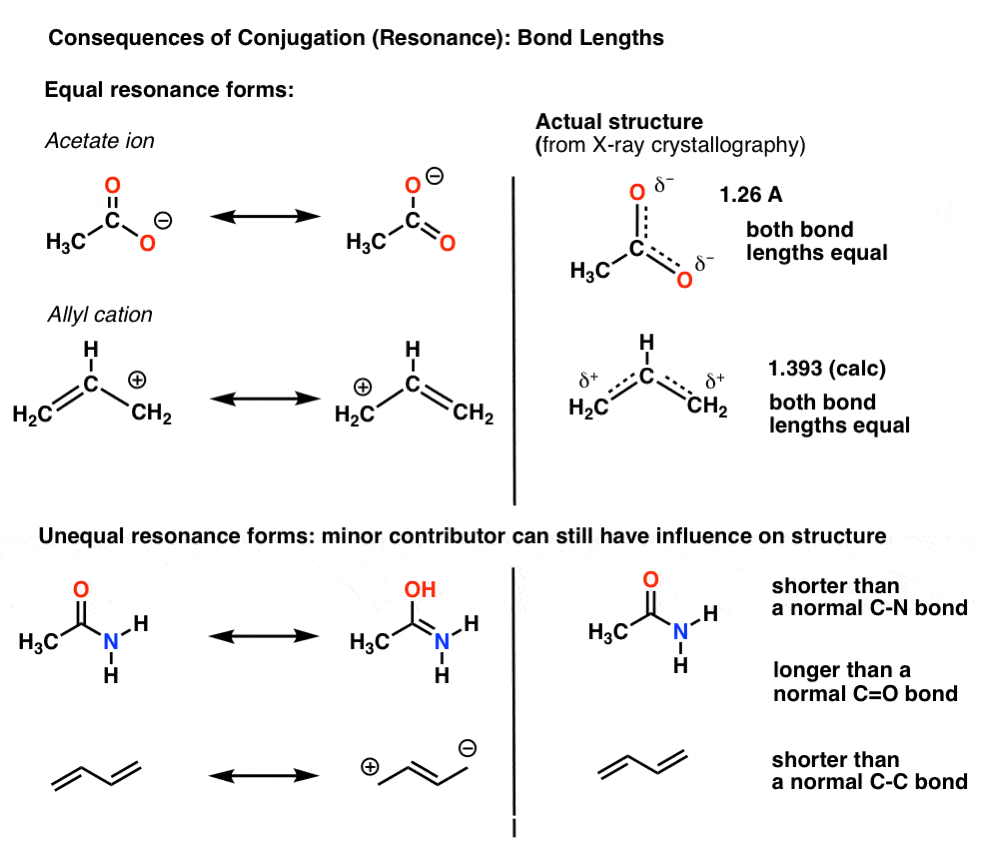
Il punto importante da notare è che gli elettroni pi in questi non cambiano costantemente avanti e indietro tra gli atomi; piuttosto, la “vera” struttura della molecola è un ibrido di queste forme di risonanza.
Una conseguenza importante della risonanza sono le lunghezze di legame che sono intermedie tra due forme.,
Quando le forme di risonanza non sono identiche, l’ibrido di risonanza sarà un ibrido “ponderato” delle più importanti forme di risonanza
Nello acetate acetato e nel catione allilico le due importanti forme di risonanza sono equivalenti, quindi entrambe finiscono per contribuire ugualmente all’ibrido.
Una situazione più comune si trova molecole come quelle qui sotto c’è una fusione di forme di risonanza disuguali. Alcune forme di risonanza sono più importanti di altre. .,
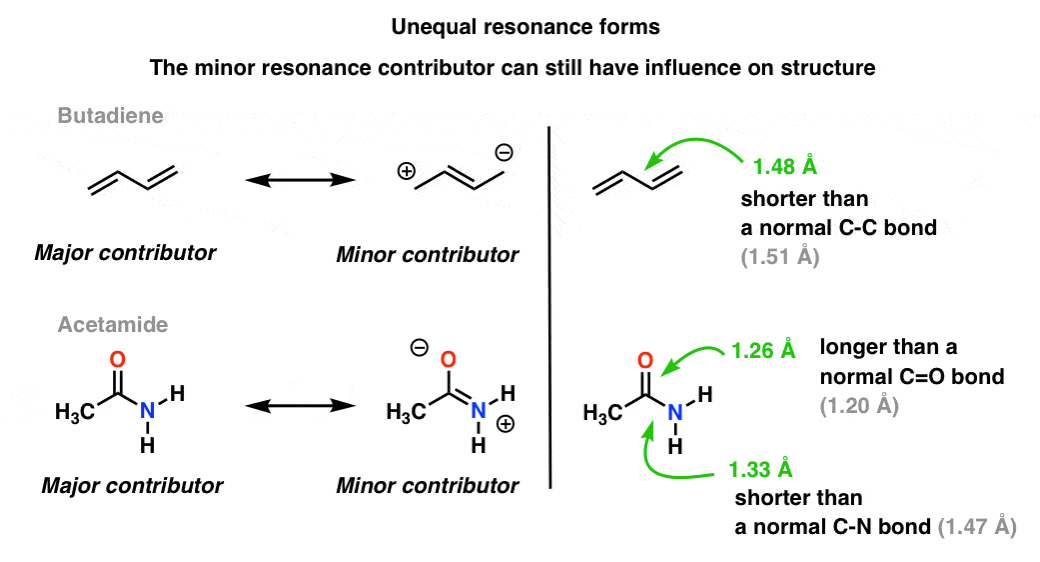
Il nostro linguaggio visivo della chimica con la sua netta distinzione tra legami singoli e doppi non descrive accuratamente la densità elettronica nelle molecole, che sono un ibrido ponderato di forme di risonanza. I contributori di risonanza minori influenzano le lunghezze di legame nella molecola, rendendole più corte o più lunghe del normale.
Nella molecola superiore (butadiene), quel legame C-C centrale è un po ‘ più corto di un legame singolo C-C “normale” (cioè ha un po’ di carattere doppio legame) a causa dell’influenza del contributore di risonanza minore all’ibrido.,
Nella molecola inferiore (“acetamide”) il legame C-O è un po’ più lungo di un legame C=O “normale” (cioè ha più carattere di legame singolo) e il legame C-N è un po’ più corto di un legame C-N “normale” (cioè ha più carattere di doppio legame). Ciò riflette l’influenza del “contributore minore” (o “secondo miglior” contributore, se ti piace) in cui c’è un legame C-N pi e un legame singolo C-O.
Facciamo il nostro primo salto concettuale.
7., Conseguenze della coniugazione (2): Doppi legami “parziali”
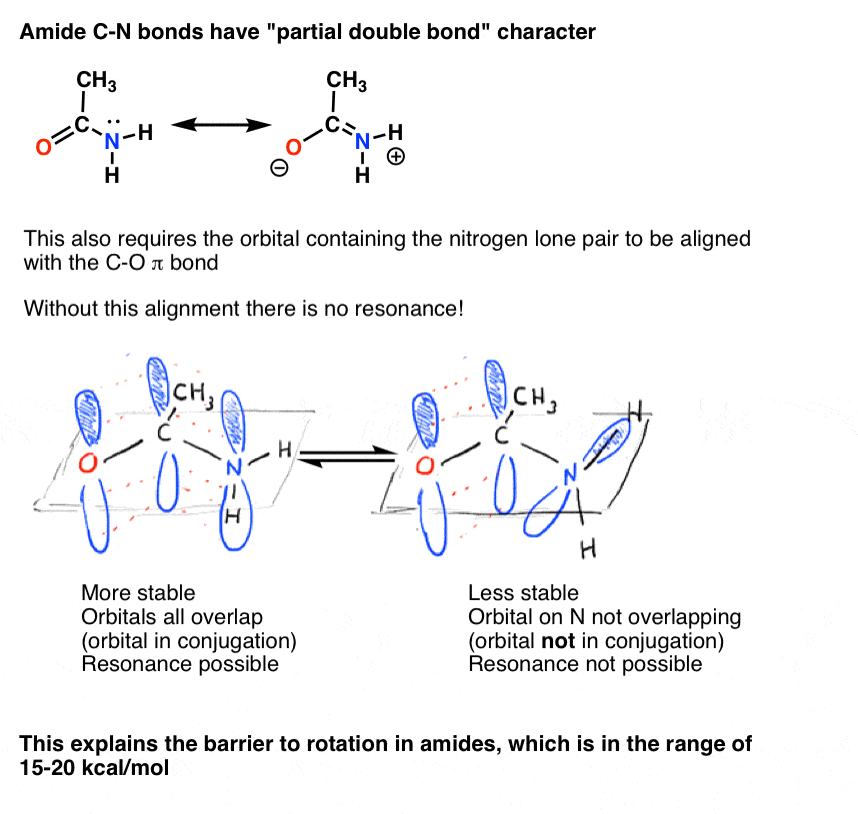
C’è una conseguenza interessante di quel “carattere di doppio legame parziale” nel legame C-n. Ha una ” barriera alla rotazione “proprio come ci aspetteremmo da un”doppio legame”! La barriera alla rotazione nel legame C-N delle ammidi è di circa 15-20 kcal / mol nei legami peptidici (confronta con circa 2-3 kcal/mol per la maggior parte dei legami C-C).
Ciò significa che le due conformazioni possono ancora interconvertirsi, ma lo fanno relativamente lentamente a temperatura ambiente., Nella molecola sottostante (N-metil acetamide) è possibile osservare separatamente il conformatore s-cis (entrambi i gruppi metilici verdi sullo stesso lato del legame C-N) e il conformatore s-trans (gruppi metilici verdi sui lati opposti del legame C-N). Questo di solito non è possibile per conformers a meno che non si prende la temperatura fino a 100 Kelvin o giù di lì!
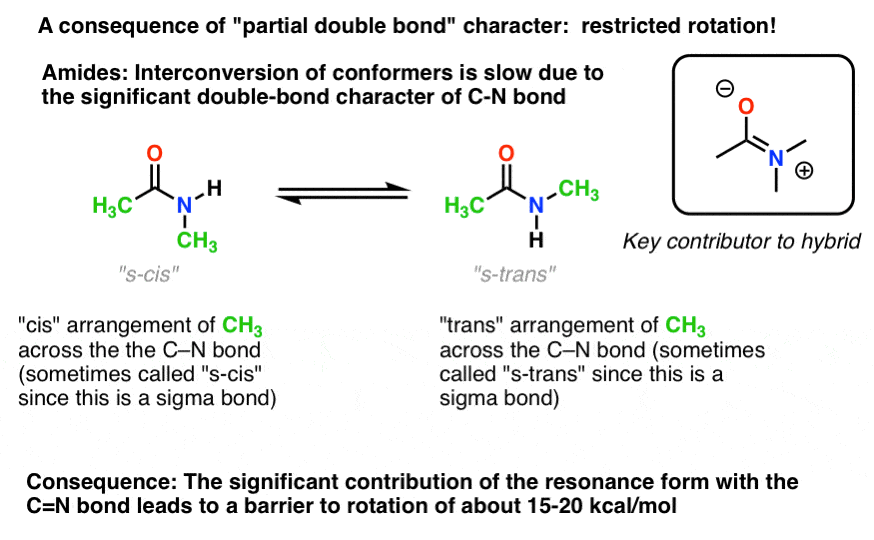
Per l’immagine sopra, il concetto cruciale qui è solo il carattere parziale del doppio legame. Se s-cis e s-trans non ha senso per te dopo averci pensato per un po’, va bene., Non cruciale per il resto della discussione.
Conseguenze della coniugazione (3): La reattività di un sistema coniugato è spesso rivelata dalla sua forma di risonanza “Second-Best”
Abbiamo mostrato l’effetto che la coniugazione (e per estensione, la risonanza) ha sulle lunghezze dei legami.
Diamo un’occhiata più da vicino al suo effetto sulla densità elettronica, che alla fine influenza la reattività.
A scopo illustrativo, continuiamo a guardare gli alcheni.
La reattività di un alchene può essere modificata drasticamente attraverso l’attaccamento di vari gruppi.,
Guarda la” seconda migliore ” forma di risonanza quando attacchiamo un donatore pi come N (CH3) 2 ad un alchene. Ciò si traduce in un accumulo di carica negativa (δ -) sul carbonio terminale dell’alchene, con il risultato che questo alchene (che chiamiamo enamina) è un eccellente nucleofilo. Per prendere solo un esempio importante, le enamine reagiscono con alogenuri alchilici (come CH3I) e altri elettrofili in una classe di reazioni a volte indicate come reazioni di enamina di cicogna dopo il loro scopritore, Gilbert Stork. Gli alcheni ordinari come il 2-butene (sotto) non funzionano in questa reazione.,
L’attacco di un accettore pi come C=O provoca un accumulo di carica positiva (δ+) sul carbonio terminale dell’alchene, con il risultato che questa specie (che chiamiamo α, β aldeide insatura, accettore di Michael o enone) è un eccellente elettrofilo. α, β carbonili insaturi reagiscono con nucleofili (come CH3S -– e molte altre classi di nucleofili in un tipo generale di reazione che chiamiamo aggiunte coniugate o talvolta reazioni di Michael.,
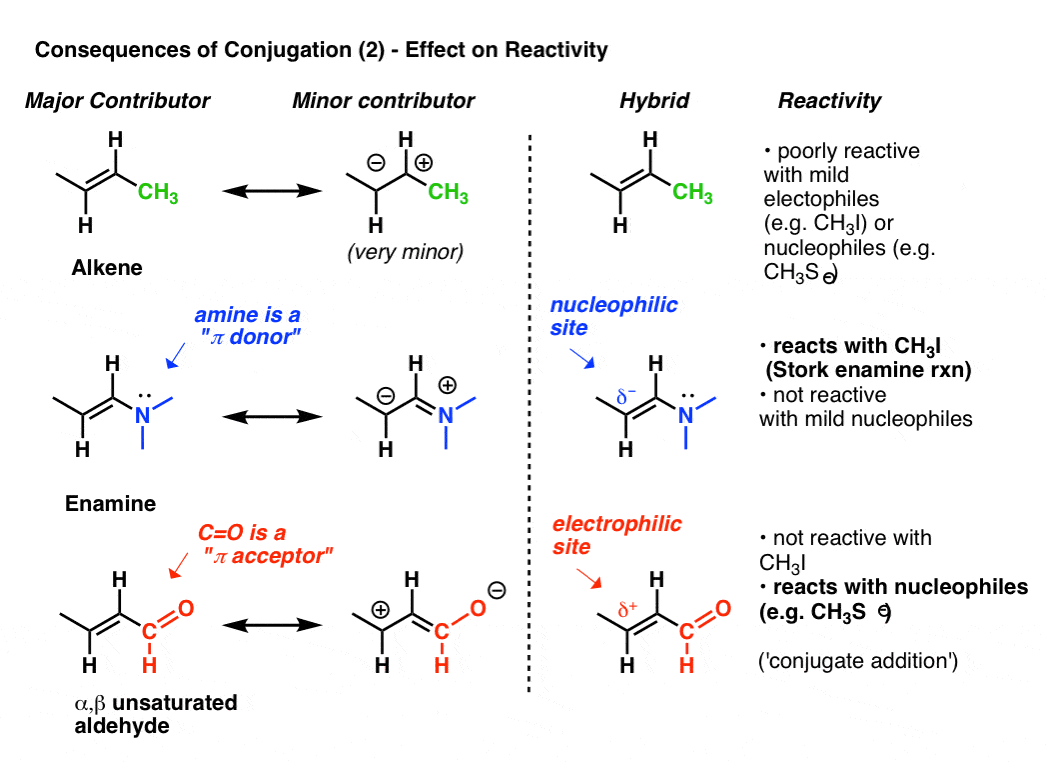
Questa è solo la punta dell’iceberg di come la coniugazione possa influenzare la reattività, ma è sufficiente per oggi.
9., Sovrapposizione orbitale (Tutti p-Orbitali Nello Stesso Piano), È Necessaria Per la Coniugazione (E Risonanza)
finora abbiamo visto che:
- sovrapposizione tra p orbitali è necessaria per formare il pi obbligazioni
- alcuni “singolo prestito obbligazionario” può avere “pi bond carattere” grazie al contributo di una minore risonanza (come ammidi, per esempio)
Qui è la logica conseguenza di queste due affermazioni:
- In ordine per la coniugazione di esistere, e quindi in ordine per risonanza si verifica, tutti gli orbitali p devono sovrapporsi. Devono quindi essere tutti allineati sullo stesso piano.,
Ricordate il ” catione allilico “che è” stabilizzato per risonanza”? Affinché la carbocation ottenga questa “stabilizzazione di risonanza”, l’orbitale p vuoto sulla carbocation deve essere allineato con il legame pi adiacente.
Se l’orbitale p è ad un angolo di 90 gradi dagli orbitali p nel legame pi, non c’è coniugazione e quindi nessuna stabilizzazione di risonanza.
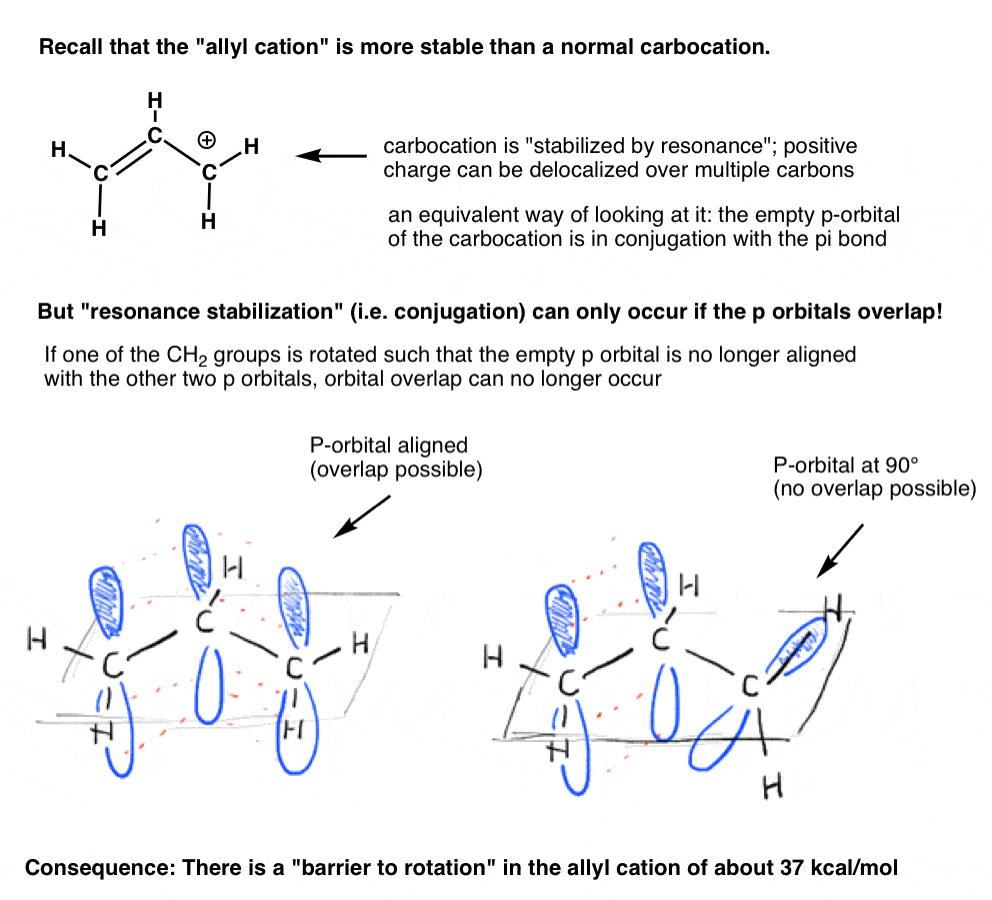
Come potremmo prevedere, c’è una barriera alla rotazione nel catione allilico, così come c’è una barriera alla rotazione in un alchene., La barriera alla rotazione nel catione allilico è di circa 37 kcal / mol-poco più della metà della forza di un legame C-C pi.
Abbiamo anche visto che il legame C-N nelle ammidi ha un carattere parziale di doppio legame, con una barriera alla rotazione di circa 15-20 kcal / mol.
Allo stesso modo, questo carattere di “doppio legame parziale” è possibile solo se l’orbitale p contenente la coppia solitaria è in grado di sovrapporsi con gli orbitali p comprendenti il legame C=O pi.,
Il carattere di doppio legame parziale del legame C-N nelle ammidi è stato a lungo considerato il motivo principale per cui sono molto più resistenti alla rottura rispetto, ad esempio, agli esteri . Poiché le proteine nel nostro corpo sono unite da legami peptidici (ammide), questa è una questione di non piccola importanza! Le forme di vita basate sull’estere piuttosto che sui legami ammidici sarebbero molto più fragili!,
Le ammidi a testa di ponte non sono coniugate e sono molto più facilmente spezzate delle ammidi “ordinarie”
Le ammidi a testa di ponte forniscono un’illustrazione di ciò che accade alle ammidi quando la sovrapposizione è impossibile.
Proprio come abbiamo visto negli alcheni a testa di ponte, nelle ammidi a testa di ponte, la sovrapposizione orbitale tra la coppia solitaria di azoto e il carbonio carbonilico è impossibile a causa della torsione. Il risultato è che il legame C-N NON ha un carattere di doppio legame parziale ed è molto più facile da rompere rispetto a un’ammide “normale”.
L’ammide della testa di ponte qui sotto è “quinuclidone”, un’ammide contorta che ha eluso la sintesi per le decadi., È stato solo nel 2006 che è stato finalmente realizzato (come il suo acido coniugato) attraverso un percorso intelligente dal laboratorio di Brian Stoltz al Caltech.
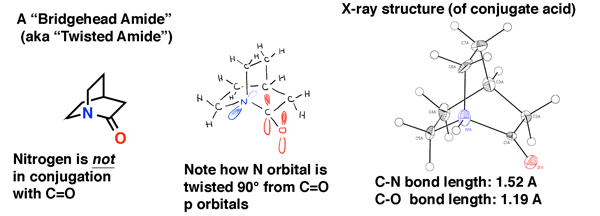
La struttura cristallina a raggi X testimonia la mancanza di coniugazione in questa ammide. La lunghezza del legame C-N è 1,52 Å (tipica di un singolo legame C-N) e la lunghezza del legame C=O è 1,19 Å, che è tipica di una lunghezza del legame in un’aldeide o chetone (1,20 Å). Ci aspetteremmo quindi che sia un po ‘ più instabile nei confronti dell’attacco nucleofilo rispetto a un’ammide normale, come è stato confermato nello studio dello Stoltz lab.,
Altre conseguenze della coniugazione: colore e cicloaddizioni
Finora, questo post è stato praticamente una recensione dei concetti del primo semestre. Non c’è nulla nella discussione sopra che non possa essere ragionevolmente spiegato da ciò che abbiamo già imparato sulla coniugazione e sulla risonanza.
Tuttavia, questo approccio semplicistico può solo portarci così lontano.
Due esempi rapidi, perché questo post è andato avanti abbastanza a lungo.,
Primo: Coniugazione e colore
Se hai visto questo post su come funziona la candeggina, hai imparato che mentre allunghiamo la lunghezza della coniugazione, cambiamo la lunghezza d’onda alla quale le molecole assorbono la luce. Alcune molecole molto vivacemente colorate come carotene, clorofilla e licopene hanno tutti doppi legami coniugati molto lunghi.
Ad esempio, il licopene è responsabile del colore rosso dei pomodori. Se togliamo i doppi legami, togliamo il colore. Perché?
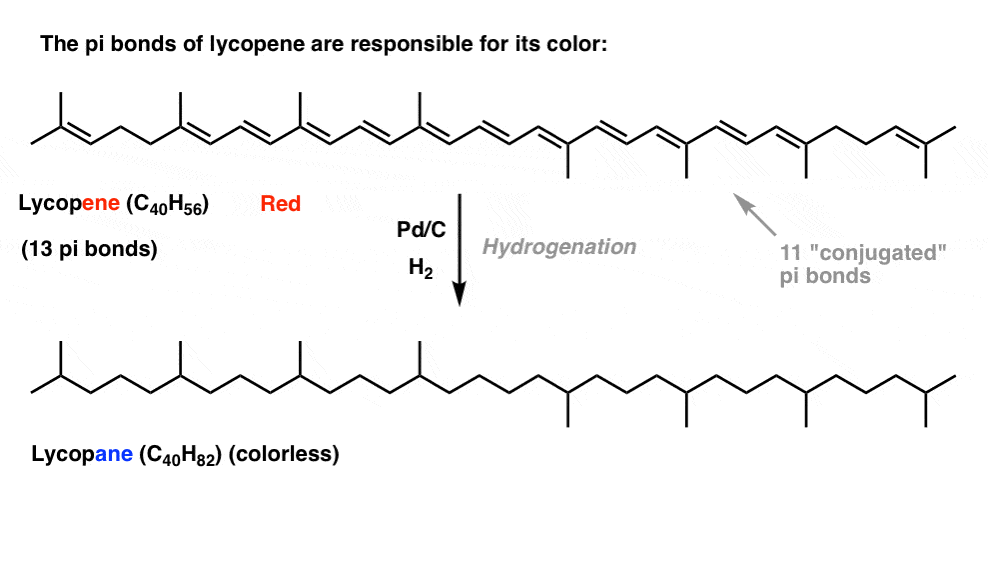
Qual è la relazione tra colore e coniugazione?, Perché il numero di doppi legami avrebbe un’influenza su questo? La risonanza non riesce a illuminare questo soggetto.
Secondo: Reazioni di dieni che formano anelli
Ecco alcune reazioni strane per te.
Se trattate il butadiene con la molecola alla sua destra (metil maleato) ottenete un nuovo prodotto contenente un anello a sei membri. Niente di ciò che abbiamo visto finora ci prepara a questo tipo di reazione, che è chiamata “cicloaddizione”.
È interessante notare che se tratti l’etene con la stessa molecola, non succede nulla (tranne se lo tratti con la luce UV., Quindi ottieni un anello a 4 membri, ma sto divagando).
PERCHÉ?
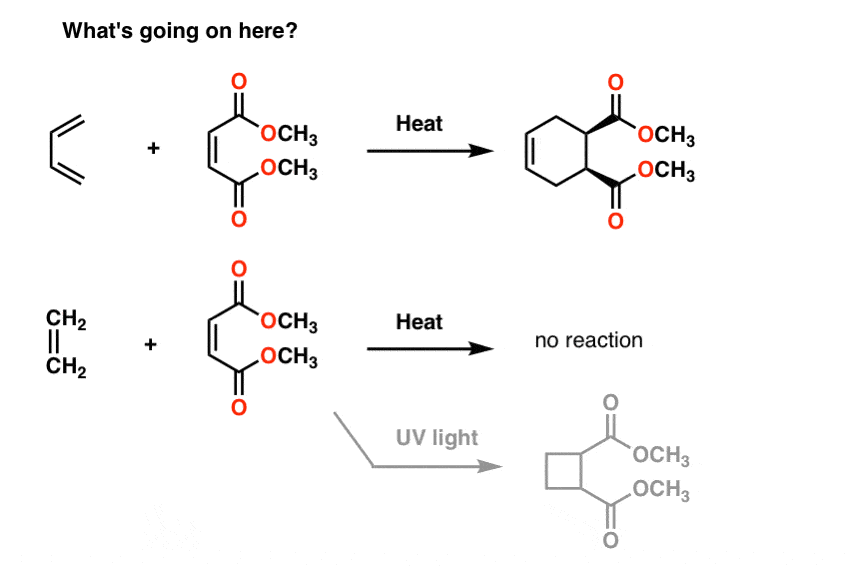
La risonanza non ci aiuta neanche qui.
Next Up: Teoria degli orbitali molecolari
Ciò che ci aiuterà a rispondere a queste domande, così come a molte altre in futuro è un concetto chiamato teoria degli orbitali molecolari.
Nei seguenti post di questa serie, approfondiremo il modo in cui gli orbitali p si sovrappongono per formare orbitali molecolari e esamineremo i livelli di energia di questi orbitali., Vedremo anche come questo influenza la reattività delle molecole e ci permette di fare previsioni sul loro comportamento chimico.
Come vedremo, la teoria degli orbitali molecolari ci fornisce un insieme molto potente di concetti che ci aiuteranno a capire la reattività chimica a un livello molto più profondo.
Grazie a Tom Struble per tutto il suo aiuto con questo post.
Note
Il ceppo A-1,2 è il motivo per cui il tetra-terz-butiletilene non è ancora stato sintetizzato.
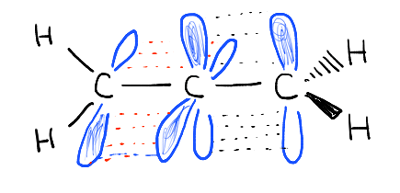
I legami pi non sono coniugati. Guarda gli orbitali che comprendono i due legami pi., Sono ad angolo retto l’uno rispetto all’altro e non possono sovrapporsi.
Utilizzando NMR, spettroscopia di risonanza magnetica nucleare. Questi isomeri conformazionali sono talvolta chiamati ” isomeri rotazionali “o” rotameri” e possono complicare notevolmente gli spettri NMR. I picchi di solito possono essere fatti fondere riscaldando la sonda del campione.
Questo è in contrasto con, ad esempio, diverse forme di sedia di cicloesano, che generalmente possono ancora interconvertirsi a temperatura ambiente e fondersi in un singolo picco., Tuttavia, se si raffredda abbastanza un cicloesano sostituito, è possibile” congelare ” i diversi conformatori e osservarli separatamente.




