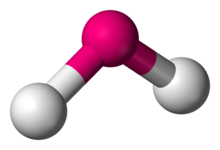
en química, las moléculas con una disposición no colineal de dos enlaces adyacentes tienen geometría molecular doblada. Ciertos átomos, como el oxígeno, casi siempre establecen sus dos (o más) enlaces covalentes en direcciones no colineales debido a su configuración electrónica. El agua (H2O) es un ejemplo de una molécula doblada, así como sus análogos. El ángulo de enlace entre los dos átomos de hidrógeno es de aproximadamente 104,45°., La geometría no lineal se observa comúnmente para otras moléculas triatómicas e iones que contienen solo elementos del grupo principal, ejemplos destacados son el dióxido de nitrógeno (NO2), el dicloruro de azufre (SCl2) y el metileno (CH2).,
H2O, SO2
C2v
90°<θ<120°
>0

difluoruro de Oxígeno, un ejemplo de una molécula con la inclinación a la geometría de coordinación.,
Esta geometría es casi siempre consistente con la teoría VSEPR, que generalmente explica la no-colinealidad de los átomos con una presencia de pares solitarios. Hay varias variantes de flexión, donde la más común es AX2E2 donde dos enlaces covalentes y dos pares solitarios del átomo central (A) forman una capa completa de 8 electrones. Tienen ángulos centrales de 104° a 109,5°, donde este último es consistente con una teoría simplista que predice la simetría tetraédrica de cuatro orbitales híbridos sp3., Los ángulos reales más comunes son 105°, 107° y 109°: varían debido a las diferentes propiedades de los átomos periféricos (X).
otros casos también experimentan hibridación orbital, pero en diferentes grados. Las moléculas AX2E1, como SnCl2, tienen solo un par solitario y el ángulo central alrededor de 120° (el centro y dos vértices de un triángulo equilátero). Tienen tres orbitales sp2. También existen compuestos AX2 hibridados sd de metales de transición sin pares solitarios: tienen el ángulo central de aproximadamente 90° y también se clasifican como doblados.




