Introduction
As reviewed by Martin (1991) one can find pericentric inversions in human in 1-2% of general population. Normalmente estos reordenamientos cromosómicos equilibrados no causan ningún problema para el portador, pero durante la meiosis hay un cierto riesgo de formación de bucle de inversión que conduce a la duplicación de novo (por ejemplo, Malinverni et al., 2016), supresión (por ejemplo, Lacbawan et al.,, 1999) o una combinación de ambos en la descendencia (tabla suplementaria 1) cuando se produce un número desigual de eventos de cruce dentro del bucle de inversión. Si esto último sucede, esto se denomina como la formación de un cromosoma recombinante. Según lo explicado por Morel et al. (2007) para la gametogénesis masculina: «un número impar de cruces dentro de los resultados de circuito en un espermatozoide que lleva el cromosoma normal, uno el inverso del cromosoma y los dos recombinantes con tanto duplicado y deficientes segmentos del cromosoma incluyendo las regiones distales a la inversión «., Además, otros reordenamientos raros pueden deberse a una inversión parental, como el cruce desigual (Yang et al., 1997), u-loop-formation (Ashley et al., 2007), rotura y reunión desigual de cromátidas hermanas dentro del bucle de inversión (Phelan et al., 1993), o incluso la formación de cromosomas de anillo (Hu et al., 2006). También se han observado recombinantes en fetos triploides (Ekblom et al., 1993).
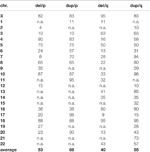
Tabla 1 Porcentaje de regiones máximas eliminadas y duplicadas por brazo cromosómico, compatible con live.,
se ha sugerido originalmente que la descendencia viable, pero con discapacidad mental y física solo puede resultar si la inversión incluye menos del 30% de la longitud del cromosoma afectado (Martin, 1991). Anteriormente, se propuso determinar la posibilidad de descendencia desequilibrada viable midiendo el porcentaje de longitud autosómica haploide de los segmentos cromosómicos distales a los puntos de ruptura de inversión (Daniel, 1981). Más tarde, Morel et al., (2007) sugirieron que no se pueden producir recombinantes cuando el tamaño del segmento invertido es <30%, algunos recombinantes cuando el tamaño del segmento invertido está dentro del 30-50% y se producen números significativos cuando el tamaño del segmento invertido es >50% de la longitud total del cromosoma afectado. No obstante, también se encontraron ejemplos de recombinantes de menos de 100 Mb de tamaño (Malan et al., 2006) o familias numerosas sin ninguna descendencia recombinante que no se ajuste a las reglas sugeridas (Van der Linden et al., 1975; Honeywell et al., 2012).,
aquí reportamos dos nuevos casos con inversión pericéntrica y descendencia con cromosomas recombinantes y proporcionamos una revisión del total de 210 casos de este tipo {más > 100 casos con «síndrome del cromosoma 8 recombinante» }. Estos datos incluyen también los 56 casos examinados en 1997 por Ishii y sus colegas. Como el origen materno preferencial de los cromosomas recombinantes ya fue mostrado por Ishii et al. (1997) esto no fue recapitulado en el presente estudio., Efectos similares son bien conocidos para los pequeños cromosomas marcadores supernumerarios (Liehr 2006) y la transmisión de otros tipos de aberraciones cromosómicas en humanos (Liehr et al., 2018). Para el impacto clínico y el impacto de inversiones paracéntricas grandes y pequeñas a submicroscópicas, siendo esta última parte de la varianza normal en humanos, ver Pettenati et al. (1995); Liehr et al. (2018) y base de datos de variantes genómicas (http://dgv.tcag.ca/dgv/app/home).,
Material y métodos
los casos estudiados
los casos incluidos aquí fueron identificados durante el diagnóstico citogenético de rutina (molecular) y se proporcionó el consentimiento informado para su publicación.
Familia 1: aquí una mujer sana tuvo dos hijos afectados con dos parejas masculinas diferentes. El primer hijo, 17y, mostró un leve deterioro mental, el enanismo, la pérdida de audición neurosensorial, y dismorfia facial; el segundo hijo, 6y, también tenía una leve deficiencia mental, microcefalia, sordera neurosensorial, signos dismórficos. Se disponía de muestras de sangre de la madre y de los dos hijos.,
Familia 2: Se estudiaron células sanguíneas y amnióticas de una mujer embarazada sana debido a anomalías ecográficas detectadas durante el diagnóstico de rutina a las 16 semanas de gestación.
pruebas citogenéticas moleculares
la sangre y / o el amnio de ambas familias fueron sometidos a cultivo celular rutinario o extracción de ADN utilizando procedimientos estándar. La preparación de la metafase se realizó de acuerdo con procedimientos estándar y los cariotipos se analizaron mediante bandas G a un nivel de banda de 4 450., La hibridación fluorescente in situ (FISH) se realizó utilizando sondas para regiones subteloméricas del cromosoma 18 (Abbott, Vysis, Wiesbaden, Alemania), pinturas cromosómicas parciales para el mismo cromosoma (sondas caseras de Liehr y Claussen, 2002) o un conjunto de sondas de bandas multicolores para el cromosoma 11 (Liehr et al., 2002). La hibridación genómica comparativa de matrices (aCGH) se realizó como se informó anteriormente(Coci et al., 2017).
búsqueda en la literatura
los casos nacidos y no nacidos con cromosomas recombinantes se reunieron en base a Ishii et al., (1997); Schinzel (2001), y buscar en https://www.ncbi.nlm.nih.gov/pubmed y https://www.google.de/. No se incluyeron aquí los casos De novo o de origen parental no esclarecido. Definitivamente, los casos reportados solo en reuniones genéticas se perdieron, ya que no son proporcionados sistemáticamente por ninguna biblioteca que no esté disponible en línea.
resultados
casos estudiados

Figura 1 resultados de citogenética molecular realizada para las familias 1 y 2., En el lado izquierdo se representa GTG-/invertido 4′,6-diamidino-2-fenilindol-resultado de banda y el resultado FISH del cromosoma normal y derivado correspondiente. A la derecha se muestran las representaciones esquemáticas del cromosoma normal, invertido y derivado/recombinante; los puntos de corte se resaltan con puntas de flecha. (A) cromosomas normales y derivados 18 de la madre y el niño 1 después de GTG-banding y FISH son visibles. Para FISH se utilizaron sondas subteloméricas para 18pter (ST 18P) y 18qter (ST18q) y pinturas cromosómicas parciales (pcps) para 18p y 18Q., B) los cromosomas normales y derivados 11 de la madre y del feto después de las bandas invertidas de 4′,6-diamidino-2-fenilindol y FISH son visibles. Para FISH se utilizó un conjunto de sondas multicolores específicas para el cromosoma 11-los resultados se representan en dos bandas pseudocolores diferentes; estas últimas tuvieron que aplicarse, debido a las diferentes cualidades de preparación de los cromosomas derivados de la sangre y el amnión. Las puntas de flecha resaltan los puntos de ruptura cromosómicos.

Figura 2 Resumen de la encuesta bibliográfica (ver tabla suplementaria 1)., Las regiones máximas de ganancias o pérdidas terminales a lo largo de cada autosoma humano y el cromosoma X se ingresan como líneas verticales verdes y rojas, cada una. Los cromosomas se clasifican de acuerdo con el número de casos notificados con un cromosoma recombinante correspondiente debido a una inversión pericéntrica parental: el número cromosómico se da como un negro grande y el número de casos notificados como un pequeño número violeta debajo de cada idiograma.,
búsqueda de Literatura
la búsqueda de Literatura reveló un total de 210 familias / casos con cromosomas recombinantes debido a una inversión pericéntrica equilibrada heredada . Se encontraron ejemplos de todos los cromosomas, aparte del cromosoma Y.
Los cromosomas recombinantes proporcionan deleciones terminales y duplicaciones al genoma humano. Con base en la tabla suplementaria 1 se dibujó un esquema en la Figura 2 destacando que las supresiones terminales y duplicaciones son compatibles con el vivo humano.,
discusión
Se añadieron dos nuevos casos de cromosomas recombinantes (rec) a los 210 casos comparables aún reportados , todos ellos debidos a una inversión pericéntrica parental. En contraste con la revisión de Ishii et al. desde 1997 hay ejemplos disponibles para todos los cromosomas humanos, excepto para el cromosoma Y. Sin embargo, los cromosomas rec(y) solo deberían ser posibles en el caso de hombres con 2 cromosomas y, uno con inversión pericéntrica; y tal instante no fue reportado todavía.,
curiosamente, un principio bien conocido de variantes de número de copias (CNVs) también se puede deducir de la Figura 2: las ganancias de números de copias son mejor compensables por el genoma humano que las pérdidas; ejemplos son los síndromes de microdeleción/microduplicación o el hecho de que solo las trisomías 13, 18 y 21 son viables, pero no las monosomías de esos tres cromosomas (Weise et al., 2012). En este estudio (Figura 2) Para prácticamente todos los cromosomas las regiones compatibles con live son más lentas para ganancias que para pérdidas de número de copias (ver también Tabla 1).,
la frecuencia observada de recombinantes es cromosómica específica, así como las diferencias relativas al surgimiento de cromosomas recombinantes viables son diferentes:
-cromosomas con más de 50 reportes resumidos en este estudio:el cromosoma 8 es el único con >100 casos reportados e incluso un número OMIM propio para un síndrome causado por este tipo de reordenamiento. Lo más probable es que esto se deba a una alta frecuencia de inv(8)(p23.1q22.1) en la población hispana en Estados Unidos (Sujansky et al., 1993).,
– cromosomas con más de 7-10 informes resumidos en este estudio: los casos que involucran los cromosomas 4 y 5 pueden haber sido observados con más frecuencia debido a estudios citogenéticos más detallados en pacientes con Wolf-Hirschhorn- (OMIM 194190) y Cri-du-Chat-syndrome (OMIM 123450), respectivamente. Los cromosomas 13, 18 y 21 son los cromosomas humanos más pobres en genes, por lo tanto, las deleciones parciales en ellos son más tolerables que en otros autosomas., Los cromosomas 7 y 11 subyacen a la impresión y, por lo tanto, también están conectados con trastornos de impresión conocidos ; por lo tanto, los pacientes con estos trastornos también pueden ser estudiados con más probabilidad que otros. Las aberraciones del cromosoma X pueden conducir a problemas con la determinación del sexo y/o infertilidad; por lo tanto, también tales aberraciones son más propensas a detectarse que otras (autosómicas)., Para los cromosomas 3 y 10 , donde también se observan regularmente recombinantes (Figura 2), estos dos cromosomas tienen en algunas poblaciones que aparecen regularmente grandes inversiones pericéntricas, como se informó para el cromosoma 8 en la población hispana en EE.
– cromosomas observados raramente resumidos en este estudio: entre los cromosomas restantes algunos son relativamente ricos en genes (como los cromosomas 1 y 19) o acrocéntricos (en los que las inversiones pericéntricas son bastante raras, chrs. 13,14, 15, 21 y 22).,
además de los factores aún discutidos que potencialmente influyen en las frecuencias de los cromosomas recombinantes en la descendencia humana viable, diferentes tasas de recombinación y puntos calientes de recombinación a lo largo de cada cromosoma Y en dependencia de la meiosis de género está pasando como bien delineado por Bhatt et al. (2014) también puede tener un impacto aquí.,
según Gardner y Amor (2018) la formación de cromosomas recombinantes en gametos de portadores de inversión pericéntricos es una función del tamaño de la inversión: cuanto mayor es la inversión, más frecuentemente se observan recombinantes en los gametos. Además, P-deletion / Q-duplication-aparecen aproximadamente en las mismas frecuencias que q-deletion / P-duplication-recombinants. Sin embargo, como ya se sugiere a partir de los datos de Ishii et al. (1997), P-deletion/Q-duplication es aproximadamente el doble de frecuente que q-deletion/P-duplication en formas viables de cromosomas recombinantes., Teniendo en cuenta la diferencia antes discutida de CNVs, que está presente como ganancias o como pérdidas, uno tendría que considerar En general un menor número de genes sensibles a la dosis en el brazo p de los cromosomas humanos que en los brazos Q.
En general, aquí se proporciona una revisión actualizada de los recombinantes viables basados en la inversión pericentromérica., Teniendo en cuenta también los nuevos conocimientos recientes sobre la influencia de los reordenamientos cromosómicos en la arquitectura interfase (palabra clave: dominios topológicamente asociados = TADs) (Schrank y Gautier, 2019), así como la superposición de puntos de corte conservados evolutivos (importantes en la especiación) y puntos de corte observados en casos clínicos (Liehr et al., 2011), se destaca la importancia de las aberraciones citogenéticas macroscópicas para proporcionar una mejor comprensión de los principios generales del genoma humano.
Declaración de disponibilidad de datos
los conjuntos de datos para este estudio se pueden solicitar a los autores.,
Declaración de Ética
no se requirió revisión y aprobación ética para el estudio con participantes humanos de acuerdo con la legislación local y los requisitos institucionales. Los pacientes / participantes proporcionaron su consentimiento informado por escrito para participar en este estudio.
contribuciones del autor
TL redactó el artículo y realizó la búsqueda de literatura. AW realizó los análisis citogenéticos de la familia 1. KM realizó los análisis aCGH de la familia 1. MZ, NP y AA-R hicieron los análisis de FISH de ambas familias. KW proporcionó información clínica a la familia 1.,
conflicto de intereses
los autores declaran que la investigación se realizó en ausencia de relaciones comerciales o financieras que pudieran ser interpretadas como un potencial conflicto de intereses.
agradecimientos
Asta Cramer y Gabriele Hickmann (Essen, Alemania) son muy reconocidos por proporcionar familia 2.
Supplementary Material
Daniel, A. (1981). Diferencias estructurales en las inversiones pericéntricas. Aplicación a un modelo de riesgo de recombinantes. Zumbido. Genet. 56, 321–328. doi: 10.,1007/BF00274687
PubMed Abstract | CrossRef Full Text/Google Scholar
Gardner, Rjmck, Amor, D. J. (2018).Anomalías cromosómicas de Gardner y Sutherland y asesoramiento genético. New York: Oxford Univeristy Press.
Google Scholar
Liehr, T. (2006). Los cromosomas marcadores supernumerarios pequeños familiares se heredan predominantemente a través de la línea materna. Genet. Mediterráneo. 8, 459–462. doi: 10.1097/00125817-200607000-00011
CrossRef Full Text / Google Scholar




