The chemical element rubidium is classed as an alkali metal. It was discovered in 1861 by Robert Bunsen and Gustav Kirchhoff.

Data Zone
| Classification: | Rubidium is an alkali metal |
| Color: | silvery-white |
| Atomic weight: | 85.,468 |
| State: | solid |
| Melting point: | 39.3 oC, 312.45 K |
| Boiling point: | 690 oC, 963 K |
| Electrons: | 37 |
| Protons: | 37 |
| Neutrons in most abundant isotope: | 48 |
| Electron shells: | 2,8,18,8,1 |
| Electron configuration: | 5s1 |
| Density @ 20oC: | 1.,53 g/cm3 |
Show more, including: Heats, Energies, Oxidation,
Reactions, Compounds, Radii, Conductivities
| Atomic volume: | 55.9 cm3/mol |
| Structure: | bcc: body-centered cubic |
| Hardness: | 0.3 mohs |
| Specific heat capacity | 0.363 J g-1 K-1 |
| Heat of fusion | 2.192 kJ mol-1 |
| Heat of atomization | 81 kJ mol-1 |
| Heat of vaporization | 72.,216 kJ mol-1 |
| 1st ionization energy | 403 kJ mol-1 |
| 2nd ionization energy | 2632.1 kJ mol-1 |
| 3rd ionization energy | 3859.4 kJ mol-1 |
| Electron affinity | 46.885 kJ mol-1 |
| Minimum oxidation number | 0 |
| Min. common oxidation no. | 0 |
| Maximum oxidation number | 1 |
| Max. common oxidation no. | 1 |
| Electronegativity (Pauling Scale) | 0.,82 |
| Polarizability volume | 47.,O, Rb2O2, Rb2O3, RbO2 (brown rubidium superoxide) |
| Hydride(s) | RbH |
| Chloride(s) | RbCl |
| Atomic radius | 248 pm |
| Ionic radius (1+ ion) | 166 pm |
| Ionic radius (2+ ion) | – |
| Ionic radius (3+ ion) | – |
| Ionic radius (1- ion) | – |
| Ionic radius (2- ion) | – |
| Ionic radius (3- ion) | – |
| Thermal conductivity | 58.,2 W m-1 K-1 |
| conductivité Électrique | 47.8 x 106 S m-1 |
| Congélation/point de Fusion: | 39.3 oC, 312.45 K |

Rubidium dans un tube en verre. Image de Dennis S. K (1).
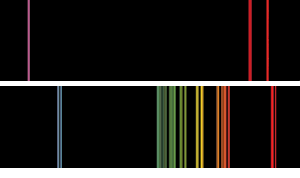
spectres D’émission de flamme de base du type que Bunsen et Kirchoff auraient pu voir. Le spectre supérieur est le potassium, avec la ligne violette distinctive., Dans le cas du rubidium, les raies rouges rubis jumelles plus loin dans la partie rouge du spectre que Bunsen et Kirchoff n’avaient jamais vues auparavant indiquaient la présence d’un nouvel élément.
découverte du Rubidium
le Rubidium a été découvert en 1861, à Heidelberg, en Allemagne, par Robert Bunsen et Gustav Kirchhoff en utilisant la spectroscopie, la méthode que le couple avait inventée et développée au cours des deux années précédentes.,
au cœur du spectroscope se trouvait un prisme de verre, qui divisait la lumière provenant d’une flamme en un spectre – de la même manière que les gouttes de pluie peuvent diviser la lumière du soleil en un arc-en-ciel. Le spectroscope a agrandi le spectre pour lui permettre d’être étudié en détail.
lorsque Bunsen et Kirchhoff ont placé différents sels dans la flamme du brûleur Bunsen récemment inventé, ils ont vu des lignes colorées dans chacun des spectres qu’ils ont pris.
avec enthousiasme, ils ont découvert que ces lignes colorées étaient uniques à la substance brûlée., Les lignes d’un spectre étaient un moyen de « prendre les empreintes » d’un élément.
Bunsen et Kirchoff avaient découvert le césium en 1860 en analysant le spectre de l’eau minérale.
en 1861, ils ont commencé à étudier la lépidolite minérale (un silicate de lithium, de potassium et d’aluminium) qui avait été trouvée en Saxe, en Allemagne. (2)
Bunsen et Kirchoff ont utilisé de l’acide chlorhydrique pour précipiter le chloroplatinate de potassium du minéral. Dans le chloroplatinate de potassium, ils ont trouvé un autre sel. (2,3)
en plaçant ce sel dans le brûleur Bunsen, ils ont vu que son spectre contenait de nombreuses nouvelles raies., Deux de ces lignes étaient particulièrement remarquables.
dans leurs notes, Bunsen et Kirchoff ont écrit: « aucune des lignes n’appartient à un corps connu auparavant. Parmi eux, deux sont particulièrement remarquables en se situant au-delà de la ligne de Fraunhofer dans la partie la plus externe du spectre solaire rouge. C’est pourquoi nous proposons pour ce nouveau métal le nom rubidium (et le symbole Rb) du latin rubidius qui a été utilisé pour exprimer la couleur rouge la plus sombre. »(3)
Bunsen a pu extraire le rubidium métallique de son sel de chlorure par électrolyse., Il a constaté que le métal était plus électropositif que le potassium et l’eau décomposée libérant de l’hydrogène. (4)
la concentration de rubidium dans la lépidolite était si faible que Bunsen et Kirchoff devaient traiter 150 kilogrammes (330 lb) du minerai pour en extraire suffisamment de métal pour étudier ses propriétés. (2)
voisinage du tableau périodique du Rubidium
le Rubidium se comporte comme un métal typique du Groupe 1. Il est doux et réagit violemment avec l’eau. Le Rubidium suit le potassium dans le Groupe 1, de sorte que ses réactions sont plus violentes que celles du potassium. le Rubidium devient liquide à 39,3 oC (102.,7 oF) – a little higher than your body temperature.
| Group 1 | Group 2 | Group 3 | |
| 4 | 19 K |
20 Ca |
21 Sc |
| 5 | 37 Rb |
38 Sr |
39 Y |
| 6 | 55 Cs |
56 Ba |
57 La |

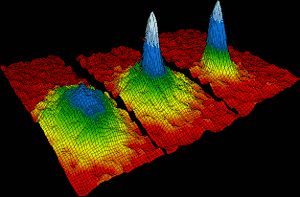
Les atomes de Rubidium se sont réunis en 1995 pour former le tout premier condensat de Bose-Einstein. Dans les 170 milliardièmes d’un degré de zéro absolu, environ deux mille atomes de rubidium individuels se sont réunis pour former un seul atome géant, qui s’est comporté comme une seule espèce. L’image de gauche montre la situation avant la formation du condensat. Sur la droite, les couleurs blanc et bleu montrent la haute densité de l’atome géant., Eric Cornell, Carl Wieman et Wolfgang Ketterle ont remporté le prix Nobel de physique 2001 pour leurs réalisations dans la fabrication de condensats de Bose Einstein.
Apparence et Caractéristiques
effets Néfastes:
Rubidium n’est pas connu pour être toxique.
Caractéristiques:
le Rubidium est un élément métallique doux, blanc argenté. Elle est solide à température ambiante mais fond facilement, à 39.3 oC.,
comme les autres métaux du groupe 1, le rubidium réagit violemment avec l’eau, formant de l’hydroxyde de rubidium corrosif (RbOH) et de l’hydrogène gazeux, qui est enflammé par la chaleur de la réaction.
le Rubidium peut également s’enflammer spontanément dans l’air. Il forme des alliages avec le césium, l’or, le sodium et le potassium et il forme des amalgames avec le mercure.
le Rubidium brûle avec une couleur de flamme rouge-violet.
utilisations du Rubidium
le Rubidium est utilisé dans les cellules photoélectriques, comme getter (décapant des gaz traces) dans les tubes à vide et comme fluide de travail dans les turbines à vapeur.,
le Rubidium-87 est légèrement radioactif et a été largement utilisé dans les roches de datation.
Les Composés de Rubidium donnent une couleur Pourpre dans les feux d’artifice.
Les sels de Rubidium sont utilisés dans les verres et les céramiques.
abondance et Isotopes
abondance croûte terrestre: 90 parties par million en poids, 21 parties par million en moles
abondance système solaire: 30 parties par milliard en Poids, 0,4 parties par milliard en moles
coût, pur: 1200 per par 100g
coût, en vrac: $par 100g
Source: le principal minerai de rubidium lépidolite qui contient 1,5% de rubidium., Le Rubidium est généralement obtenu comme sous – produit de la production de lithium. Le Rubidium métal peut également être produit en réduisant le chlorure de rubidium avec du calcium.
Isotopes: le Rubidium a 29 isotopes dont les demi-vies sont connues, avec des nombres de masse de 74 à 102. Le rubidium naturel est un mélange de deux isotopes, 85Rb et 87Rb avec des abondances naturelles de 72,2% et 27,8% respectivement.,

Citer cette Page
Pour les liens en ligne, s’il vous plaît copiez et collez l’une des opérations suivantes:
<a href="https://www.chemicool.com/elements/rubidium.html">Rubidium</a>
ou
<a href="https://www.chemicool.com/elements/rubidium.html">Rubidium Element Facts</a>
Pour citer cette page dans un document académique, veuillez utiliser les informations suivantes MLA conforme citation:
"Rubidium." Chemicool Periodic Table. Chemicool.com. 18 Oct. 2012. Web. <https://www.chemicool.com/elements/rubidium.html>.




