quelles sont les concentrations environnementales d’O2 et de CO2?
Mode Lecteur
nous savons tous que l’air que nous respirons est composé de 20% d’oxygène. La concentration de dioxyde de carbone a récemment dépassé les niveaux de 400 parties par million, Les plus élevés depuis des millions d’années, pompés par les activités humaines. Ces gaz atmosphériques sont essentiels aux modes de vie des plantes et des animaux. Cependant, les réactions biologiques ont lieu dans des milieux liquides et devraient donc dépendre de la solubilité de ces constituants inorganiques clés., Quelles concentrations d’oxygène et de dioxyde de carbone les cellules voient-elles dans leur vie quotidienne dans les milieux aqueux dans lesquels elles vivent?
Les organismes vivants sont constitués de quatre principaux types d’atomes: le carbone, l’oxygène, l’azote et l’hydrogène. Dans le corps humain, ensemble, ils représentent ≈96% du poids humide et ≈87% du poids sec comme indiqué dans la vignette « Quelle est la composition élémentaire d’une cellule?”. Cependant, la réserve de ces constituants dans le milieu cellulaire est souvent limitée. Par exemple, comme nous le verrons ci-dessous l’oxygène est soluble dans l’eau à environ 10 parties par million., Dans le cas du carbone et de l’azote, ces atomes sont liés sous une forme inorganique relativement inerte séquestrée dans le CO2 et le N2, respectivement. En conséquence, les cellules doivent trouver des moyens d’extraire ces molécules de ces réservoirs autrement inaccessibles et de les convertir en une forme utilisable. Bien que » eau” et « air” soient connus de tous de la même manière que quiconque vit dans les climats nordiques a une réponse viscérale au mot « neige », on oublie souvent que ces mots de la langue vernaculaire commune masquent une riche réalité moléculaire.,
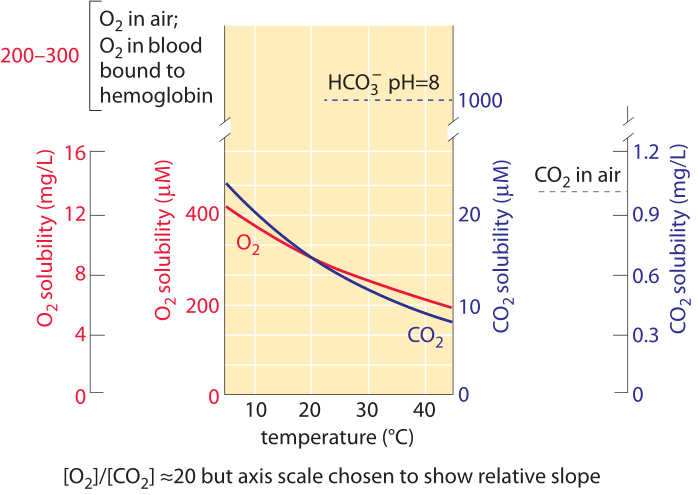
Figure 1: la solubilité de l’oxygène et du dioxyde de carbone dans l’eau et leur dépendance à la température dans une composition d’air normale. Les valeurs de l’axe Y pour les deux gaz ont été choisies pour permettre la comparaison du changement avec la température, mais notez que l’échelle de concentration en oxygène est 10 fois plus grande. La concentration d’oxygène dans l’air est environ 500 fois plus élevée que le CO2, mais l’oxygène est environ 50 fois moins soluble. Pour les deux gaz, la concentration est plus faible à des températures plus élevées., À mesure que la température augmente, la disponibilité de CO2 diminue plus rapidement que celle de l’oxygène. Le Bicarbonate (HCO3 -) est la forme inorganique la plus abondante de carbone dans la plage de pH 6-10. L’oxygène dans le sang est transporté principalement lié à l’hémoglobine à une concentration similaire à celle de l’oxygène dans l’air. Cette concentration est environ 50 fois plus élevée que ce qui serait transporté par le liquide sanguin sans hémoglobine. La parcelle se réfère à l’eau Douce; la solubilité est d’environ 20 à 30% inférieure dans l’eau salée de l’océan. Données dans les courbes calculées par les auteurs sur la base de la Loi de Henry.,
Le carbone pénètre dans la biosphère lorsqu’il passe de sa forme oxydée en CO2 à une forme réduite principalement dans le motif de répétition des glucides (CHOH)N. ce motif constitue les sucres en général et est le composant principal des parois cellulaires présentes dans les microbes et les plantes qui composent la majeure partie de la matière organique Cette transformation se produit dans un processus connu sous le nom de fixation du carbone effectuée par des plantes, des algues et une gamme de bactéries connues sous le nom d’autotrophes., La concentration de CO2 dissous dans l’eau à l’équilibre avec l’atmosphère est ≈10 µM (BNID 108697) comme le montre la Figure 1. Cela signifie qu’il ya seulement environ 104 molécules de CO2 dans un volume d’eau de la taille d’une bactérie. Cela devrait être comparé aux atomes de carbone 1010 qui sont nécessaires pour constituer une bactérie. La concentration D’O2 est également assez faible à ≈100-300 µM (BNID 109182 et voir la Figure 1 pour apprécier comment cette solubilité change avec la température). La solubilité de l’oxygène dans l’eau est environ 50 fois plus petite que celle du CO2., En conséquence, même si l’oxygène dans l’air est environ 500 fois plus abondant que le CO2, le rapport de concentration entre O2 et CO2 en solution est d’environ 10 plutôt que 500. Par définition, chaque mg / L de la Figure 1 est une partie par million en termes de masse, de sorte que la rareté de l’oxygène et du dioxyde de carbone peut être directement appréciée en notant que la concentration de ces gaz est dans le domaine à un chiffre en termes de mg/L et donc aussi très peu de parties par million. Le CO2 a la particularité supplémentaire de réagir avec l’eau pour donner, à des valeurs de pH physiologiquement pertinentes, principalement du bicarbonate (HCO3–)., À pH 7, Il y a environ 10 fois plus de carbone inorganique sous forme de bicarbonate que de CO2 dissous. À pH 8, caractéristique de l’eau de mer, il y a 100 fois plus de bicarbonate que de CO2 dissous. Ces pools sont importants pour quiconque vise à évaluer les pools de carbone inorganique disponibles pour les cellules. Plus précisément, le recensement de ces réservoirs moléculaires est important pour comprendre la séquestration du carbone dans les océans ou le transport du carbone inorganique dans notre sang des tissus aux poumons., La transition du CO2 au bicarbonate et vice versa est renforcée par l’action de l’anhydrase carbonique. Cette transition permet à la cellule de reconstituer le petit réservoir de CO2 rapidement épuisé à partir du réservoir beaucoup plus grand de carbone inorganique sous forme de bicarbonate.
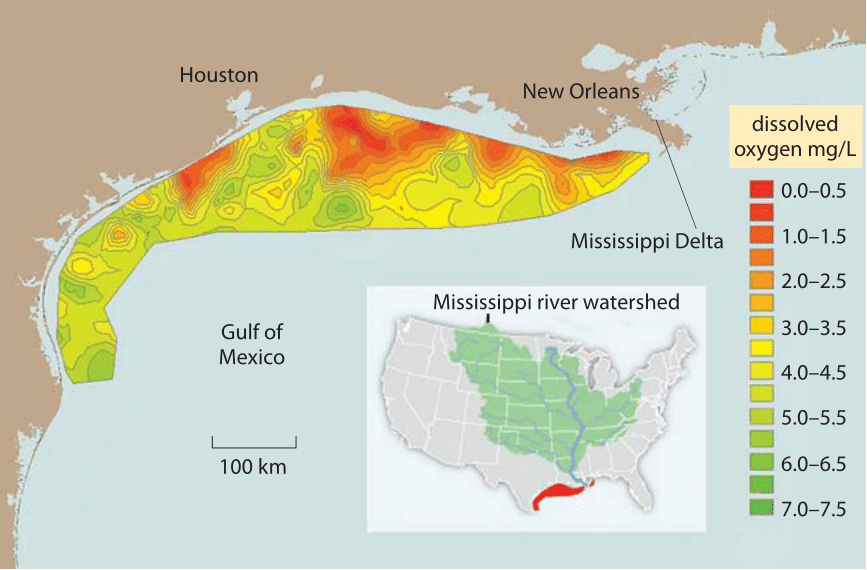
Figure 2: Zone morte dans le golfe du Mexique en raison des engrais agricoles portés par le fleuve Mississippi., La moyenne à long terme pour la zone d’hypoxie des eaux de fond en milieu d’été (colorée en rouge), où les niveaux d’oxygène dissous <2 mg/l (zone morte, où l’appauvrissement en oxygène entraîne l’asphyxie des poissons) est de 13 000 km carrés, à propos de la région du Connecticut. Les valeurs indiquent l’oxygène mesuré aux stations de fond de mer. Normal, saturation presque complète avec (l’oxygène se traduit par des concentrations d’environ 7-9 mg/L comme le montre la Figure 1. 1 mg/L est d’environ 1 partie par million. Les valeurs pour d’autres parties du Golfe du Mexique ne sont pas indiquées parce qu’il n’y a pas de stations de mesure à cet endroit., (Figure adaptée de NOAA. http://service.ncddc.noaa.gov/rdn/www/media/hypoxia/maps/2011-hypoxia-contours.jpg http://www.ncddc.noaa.gov/hypoxia/products/ http://si.wsj.net/public/resources/images/NA-AZ768A_DEADZ_NS_20090817185740.jpg http://toxics.usgs.gov/hypoxia/hypoxic_zone.html)
Dans de nombreux milieux aqueux de la faible solubilité et de la lente diffusion de l’O2 est une limitation importante pour le métabolisme aérobie des organismes. Par exemple, considérons le problème environnemental aigu de l’eutrophisation, le processus par lequel l’oxygène s’épuise lorsque des quantités excessives d’engrais contenant de l’azote et du phosphore sont lavées dans un bassin d’eau auparavant limité en nutriments, conduisant à la floraison du plancton., Lorsque le plancton coule par la suite, sa biomasse est respirée par des bactéries qui consomment de l’oxygène dans le processus. L’apport limité en oxygène se traduit par d’énormes zones mortes dans le golfe du Mexique, certaines aussi grandes que la zone occupée par l’état du Connecticut, comme le montre la Figure 2. Alors que la concentration d’oxygène peut limiter la respiration chez certains organismes, pour ceux qui effectuent la fixation du carbone, elle peut en fait être trop élevée. Comme le montre la Figure 1, la solubilité dépend de la température, de sorte qu’il y a relativement moins de CO2 par rapport à O2 à des températures plus élevées., Ceci est suggéré pour conduire la pression sélective menant aux plantes C4 (par exemple le maïs et la canne à sucre), qui utilisent des pompes métaboliques pour augmenter localement les concentrations de CO2 pour la fixation du carbone.
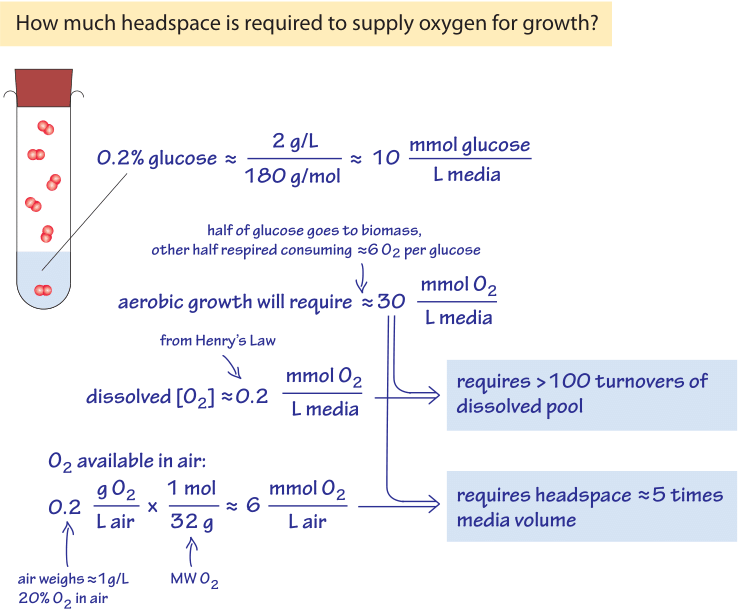
Figure 3: Dos du calcul de l’enveloppe sur la disponibilité de l’oxygène pour la croissance en milieu liquide& l’espace de tête de la chambre de croissance rempli d’air.
pour illustrer la signification des faibles concentrations d’oxygène trouvées dans les environnements marins dans un contexte de laboratoire familier, pensez à une culture nocturne de bactéries., Les cellules se développent à partir d’un petit nombre de cellules à saturation à une OD600 d’environ 1 (correspondant à environ 100-1000 millions de cellules bactériennes par mL comme discuté dans la vignette sur « quelle est la concentration de cellules bactériennes dans une culture saturée?”), dans des conditions qui peuvent largement être décrites comme aérobies. La croissance est facilitée par un sucre tel que le glucose dans les milieux (disons 0,2% en masse, équivalent à ≈10mm). Un calcul simple concernant les besoins en oxygène d’une telle croissance est représenté schématiquement dans la Figure 3., Comme scénario de référence raisonnable, considérons qu’environ la moitié de ce sucre sera utilisée pour construire de la biomasse et l’autre moitié pour produire de l’énergie (comme en témoigne l’observation selon laquelle le rendement en carbone stocké sous forme de biomasse à partir du carbone prélevé dans les milieux de croissance est généralement ≈0,5, BNID 105318). La stœchiométrie du processus de respiration est telle que pour chaque molécule de glucose, 6 molécules D’O2 sont utilisées. Par conséquent, dans un système fermé, 5 mM de glucose respiré pour produire de l’énergie nécessiteront environ 30 mM d’oxygène., La concentration d’oxygène a été notée ci-dessus pour être dans les centaines de µM, qui est environ 100 fois plus faible. Nous pouvons donc conclure, comme calculé à la Figure 3, qu’il faudra plus de 100 cycles de réapprovisionnement (retournements) du pool d’oxygène dissous dans le milieu de croissance pour répondre aux besoins de respiration du glucose. Le réapprovisionnement est généralement réalisé par des secousses vigoureuses, des bouillonnements ou des roues spéciales. Le milieu de croissance est entouré d’air qui a une fraction d’oxygène de 20% équivalente à environ 10 µmol par litre (d’air)., Comme analysé dans la Figure 3, un espace de tête de quelques fois le volume de culture contient suffisamment d’oxygène pour la croissance de la culture, tant que l’aération est suffisamment vigoureuse pour dissoudre l’oxygène de l’espace de tête dans le milieu liquide. Comme autre façon de penser à cette estimation, considérons la règle empirique selon laquelle la conversion du glucose en biomasse bactérienne nécessite environ 1 g d’O2 pour 1 g de poids sec cellulaire produit (la majeure partie étant émise par la respiration sous forme de CO2)., Un OD600 de 1 a environ 1 g de poids sec Cellulaire par litre qui nécessitera 1 g d’oxygène, ou 30 mmol, conformément à la dérivation ci-dessus.
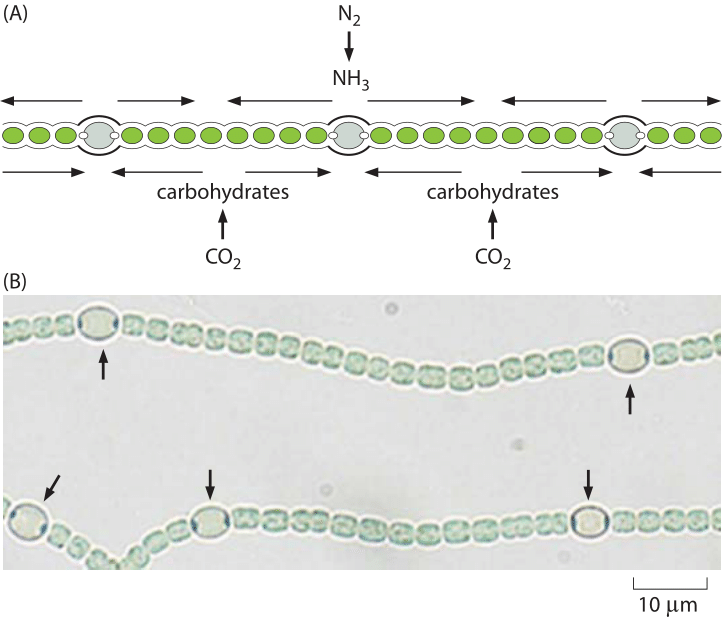
Figure 4: Hétérocystes dans Anabaena. (A) schéma montrant le positionnement régulier des hétérocystes dans Anabaena qui convertissent le dinitrogène en ammoniac. B) images de microscopie montrant à la fois des cellules végétatives et des hétérocystes (marquées par des flèches). (Adapté de physical Biology of the Cell, 2e édition., Garland Science, 2012)
L’oxygène n’est pas le seul composant cellulaire critique dont l’approvisionnement est limité. L’azote, qui comprend environ 80% de l’atmosphère terrestre, est très inerte car il est presque exclusivement lié sous forme de N2. Cet azote est arrivé dans l’atmosphère par l’action de bactéries qui utilisent l’azote comme accepteur d’électrons dans un processus connu sous le nom de dénitrification (un autre exemple de la façon dont la biologie aide à façonner la terre). Pour rendre l’azote atmosphérique à nouveau disponible pour la biochimie, il est nécessaire de mettre en place un processus difficile, c’est-à-dire, transformer l’azote en ammonium (NH4+), nitrates (NO3–) ou nitrites (NO2–). Les organismes capables d’effectuer ce processus de fixation de l’azote sont des organismes unicellulaires tels que les partenaires symbiotiques microbiens trouvés aux racines des légumineuses. Une seule enzyme est capable de mener à bien ce processus, à savoir la nitrogénase. La nitrogénase est sensible à l’oxygène, ce qui nécessite un environnement local dépourvu d’oxygène, ce qui conduit certains systèmes microbiens à développer des cellules spécialisées appelées hétérocystes, comme le montre la Figure 4, qui sont le site de ces transactions d’azote., À l’échelle mondiale, le cycle naturel de fixation de l’azote est augmenté par l’humanité grâce à une quantité comparable d’azote réduit obtenue dans le processus industriel Haber-Bosch, ce qui donne des engrais essentiels pour nourrir une grande partie de l’humanité mais qui entraînent également l’eutrophisation écologique mentionnée ci-dessus. Le fait que les humains modifient les principaux cycles biogéochimiques impliquant les pools de ces substances inorganiques clés nous incite à réfléchir à ce qui est effectivement une expérience géante, dirigée par l’homme, engagée dans la modification de la biosphère.,









