en chimie, les molécules avec un arrangement non colinéaire de deux liaisons adjacentes ont une géométrie moléculaire courbée. Certains atomes, tels que l’oxygène, placeront presque toujours leurs deux (ou plus) liaisons covalentes dans des directions non colinéaires en raison de leur configuration électronique. L’eau (H2O) est un exemple de molécule courbée, ainsi que ses analogues. L’angle de liaison entre les deux atomes d’hydrogène est d’environ 104.45°., La géométrie non linéaire est couramment observée pour d’autres molécules et ions triatomiques contenant uniquement des éléments du groupe principal, des exemples importants étant le dioxyde d’azote (NO2), le dichlorure de soufre (SCl2) et le méthylène (CH2).,
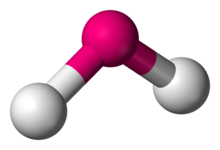
H2O, SO2
C2v
90°<θ<120°
>0

le difluorure d’Oxygène, un exemple d’une molécule avec le penchant de la coordination de la géométrie.,
Cette géométrie est presque toujours compatible avec la théorie VSEPR, qui explique généralement la non-colinéarité des atomes avec une présence de paires isolées. Il existe plusieurs variantes de flexion, dont la plus courante est AX2E2 où deux liaisons covalentes et deux paires isolées de l’atome central (A) forment une coque complète à 8 électrons. Ils ont des angles centraux de 104° à 109,5°, ce dernier étant compatible avec une théorie simpliste qui prédit la symétrie tétraédrique de quatre orbitales hybrides sp3., Les angles réels les plus courants sont 105°, 107° et 109°: ils varient en raison des propriétés différentes des atomes périphériques (X).
D’autres cas connaissent également une hybridation orbitale, mais à des degrés différents. Les molécules AX2E1, telles que SnCl2, n’ont qu’une seule paire et l’angle central d’environ 120° (le centre et les deux sommets d’un triangle équilatéral). Ils ont trois orbitales sp2. Il existe également des composés ax2 hybridés sd de métaux de transition sans paires solitaires: ils ont l’angle central d’environ 90° et sont également classés comme courbés.




