Introduction
selon Martin (1991), on peut trouver des inversions péricentriques chez l’homme chez 1 à 2% de la population générale. Normalement, ces réarrangements chromosomiques équilibrés ne posent aucun problème au porteur, mais pendant la méiose, il existe un certain risque de formation de boucles d’inversion conduisant à une duplication de novo (par exemple Malinverni et al., 2016), suppression (par exemple Lacbawan et al.,, 1999) ou une combinaison des deux dans la descendance (Tableau supplémentaire 1) lorsqu’un nombre inégal d’événements de croisement se produisent dans la boucle d’inversion. Si ce dernier se produit, il s’agit de la formation d’un chromosome recombinant. Comme expliqué par Morel et coll. (2007) pour la gamétogenèse masculine: « un nombre impair de croisements dans la boucle entraîne un spermatozoïde portant le chromosome normal, un chromosome inversé et deux recombinants avec des segments chromosomiques dupliqués et déficients, y compris les régions distales de l’inversion « ., En outre, d’autres réarrangements rares peuvent être dus à une inversion parentale, comme le croisement inégal (Yang et al., 1997), U-boucle-formation (Ashley et coll., 2007), la rupture et la réunion inégale de chromatides sœurs dans la boucle d’inversion (Phelan et al., 1993), ou même la formation de chromosomes en anneau (Hu et al., 2006). En outre, des recombinants ont été observés chez les fœtus triploïdes (Ekblom et al., 1993).
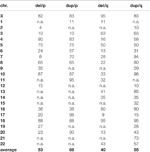
Tableau 1 Pourcentage de régions supprimées et dupliquées au maximum par bras chromosomique, compatibles avec live.,
Il a été initialement suggéré que la descendance viable, mais déficiente mentale et physique, ne peut en résulter que si l’inversion comprend moins de 30% de la longueur du chromosome affecté (Martin, 1991). Auparavant, il était proposé de déterminer la possibilité d’une descendance déséquilibrée viable en mesurant le pourcentage de longueur autosomique haploïde des segments chromosomiques distaux des points d’inversion-rupture (Daniel, 1981). Plus tard, Morel et coll., (2007) ont suggéré qu’aucun recombinant ne peut être produit lorsque la taille du segment inversé est <30%, quelques recombinants lorsque la taille du segment inversé est comprise entre 30 et 50% et des nombres significatifs sont produits lorsque la taille du segment inversé est >50% de Néanmoins, des exemples ont également été trouvés pour des recombinants de moins de 100 Mo (Malan et al., 2006) ou des familles nombreuses sans progéniture recombinante ne correspondant pas aux règles suggérées (Van der Linden et al., 1975; Honeywell et coll., 2012).,
Nous rapportons ici deux nouveaux cas avec inversion péricentrique et progéniture avec chromosomes recombinants et fournissons un examen de l’ensemble de 210 cas de ce type {plus> 100 cas avec « syndrome du chromosome 8 recombinant » }. Ces données comprennent également les 56 cas examinés en 1997 par Ishii et ses collègues. Comme origine maternelle préférentielle des chromosomes recombinants a déjà été montré par Ishii et al. (1997) cela n’a pas été récapitulé dans la présente étude., Des effets similaires sont bien connus pour les petits chromosomes marqueurs surnuméraires (Liehr 2006) et la transmission d’autres types d’aberrations chromosomiques chez l’homme (Liehr et al., 2018). Pour l’impact clinique et l’impact des inversions paracentriques grandes et petites à submicroscopiques, ces dernières faisant partie de la variance normale chez l’homme, voir Pettenati et al. (1995); Liehr et coll. (2018) et base de données des variantes génomiques (http://dgv.tcag.ca/dgv/app/home).,
matériel et méthodes
les cas étudiés
les cas inclus ici ont été identifiés lors de diagnostics cytogénétiques (moléculaires) de routine et un consentement éclairé pour la publication a été fourni.
famille 1: ici, une femme en bonne santé avait deux enfants touchés avec deux partenaires masculins différents. Le premier fils, 17y, présentait une légère déficience mentale, un nanisme, une perte auditive neurosensorielle et un dysmorphisme facial; le deuxième fils, 6y, présentait également une légère déficience mentale, une microcéphalie, une perte auditive neurosensorielle et des signes dysmorphiques. Des échantillons de sang étaient disponibles auprès de la mère et des deux enfants.,
famille 2: des cellules sanguines et amnion d’une femme enceinte en bonne santé ont été étudiées en raison d’anomalies échographiques détectées lors de diagnostics de routine à 16 semaines de gestation.
tests cytogénétiques moléculaires
Le Sang et / ou l’amnion des deux familles ont été soumis à une culture cellulaire de routine ou à une extraction D’ADN en utilisant des procédures standard. La préparation de la métaphase a été effectuée selon les procédures standard et les caryotypes ont été analysés par bande G à un niveau de bande ∼450., L’hybridation in situ par Fluorescence (FISH) a été réalisée à l’aide de sondes pour les régions subtélomères du chromosome 18 (Abbott, Vysis, Wiesbaden, Allemagne), de peintures chromosomiques partielles pour le même chromosome (sondes brassées à la maison de Liehr et Claussen, 2002) ou d’un ensemble de sondes à bandes multicolores pour le chromosome 11 (Liehr et al., 2002). L’hybridation génomique comparative Array (aCGH) a été réalisée comme indiqué précédemment (Coci et al., 2017).
recherche dans la littérature
Les cas nés et à naître avec des chromosomes recombinants ont été rassemblés sur la base D’Ishii et al., (1997); Schinzel (2001), et la recherche dans un https://www.ncbi.nlm.nih.gov/pubmed et https://www.google.de/. Les cas De novo ou autres dont l’origine parentale n’a pas été clarifiée n’ont pas été inclus ici. Il est certain que les cas signalés uniquement sur les réunions génétiques ont été manqués, car ceux-ci ne sont pas fournis systématiquement par les bibliothèques qui ne sont pas disponibles en ligne.
résultats
cas étudiés

Figure 1 Résultats de cytogénétique moléculaire réalisés pour les familles 1 et 2., Sur le côté gauche, GTG – / inversé 4′,6-diamidino-2-phénylindole-résultat de baguage et résultat de poisson du chromosome normal et dérivé correspondant est représenté. Sur la droite, des représentations schématiques du chromosome normal, inversé et dérivé/recombinant sont montrées; les points d’arrêt sont mis en évidence par des têtes de flèche. (A) les chromosomes normaux et dérivés 18 de la mère et de l’enfant 1 après le baguage GTG et le poisson sont visibles. Pour les poissons, des sondes subtélomères pour 18pter (ST 18P) et 18qter (ST18q) et des peintures chromosomiques partielles (PCP) pour 18p et 18Q ont été utilisées., (B) les chromosomes normaux et dérivés 11 de la mère et de l’enfant à naître après 4’inversé,6-diamidino-2-phénylindole-bandes et poissons sont visibles. Pour les poissons, un ensemble de sondes de baguage multicolore spécifique au chromosome 11 a été utilisé—les résultats sont représentés dans deux bandages pseudocolor différents; ce dernier a dû être appliqué, en raison des différentes qualités de préparation des chromosomes dérivés du sang et de l’amnion. Les pointes de flèches mettent en évidence les points d’arrêt chromosomiques.

la Figure 2 Résumé de la documentation de l’enquête (voir Tableau Supplémentaire 1)., Les régions maximales de gains ou de pertes terminales le long de chaque autosome humain et du chromosome X sont entrées sous forme de lignes verticales vertes et rouges, chacune. Les Chromosomes sont triés en fonction du nombre de cas signalés avec un chromosome recombinant correspondant en raison d’une inversion péricentrique parentale—le nombre de chromosomes est donné sous la forme d’un grand noir et le nombre de cas signalés sous la forme d’un petit nombre violet en dessous de chaque idiogramme.,
recherche documentaire
la recherche documentaire a révélé au total 210 familles / cas avec des chromosomes recombinants en raison d’une inversion péricentrique équilibrée héréditaire . Des exemples pour tous les chromosomes ont été trouvés, à l’exception du chromosome Y.
Les chromosomes recombinants fournissent des délétions terminales et des duplications au génome humain. Sur la base du tableau supplémentaire 1, un schéma a été établi à la Figure 2 mettant en évidence que les suppressions et les duplications terminales sont compatibles avec le vivant humain.,
Discussion
deux nouveaux cas de chromosomes recombinants (rec) ont été ajoutés aux 210 cas comparables encore signalés , qui sont tous dus à une inversion péricentrique parentale. Contrairement à L’examen D’Ishii et al. à partir de 1997, il existe maintenant des exemples disponibles pour tous les chromosomes humains, à l’exception du chromosome Y. Cependant, les chromosomes rec (Y) ne devraient être possibles que dans le cas d’hommes avec 2 chromosomes Y, dont un avec inversion péricentrique; et un tel instant n’a pas encore été signalé.,
fait intéressant, un principe bien connu des variants du nombre de copies (CNVs) peut également être déduit de la Figure 2: les gains de nombres de copies sont mieux compensables par le génome humain que les pertes; des exemples sont les syndromes de microdélétion / microduplication ou le fait que seules les trisomies 13, 18 et 21 sont viables mais pas les monosomies de ces trois chromosomes (Weise et al., 2012). Dans cette étude (Figure 2) pour pratiquement tous les chromosomes, les régions compatibles avec le vivant sont plus Lager pour les gains que pour les pertes de nombre de copies (Voir Aussi Tableau 1).,
la fréquence observée des recombinants est spécifique aux chromosomes, ainsi que les différences concernant l’apparition de chromosomes recombinants viables sont différentes:
-Chromosomes avec plus de 50 rapports résumés dans cette étude:le Chromosome 8 est le seul avec >100 cas signalés et même un nombre OMIM propre genre de réarrangement. Cela est probablement dû à une fréquence élevée d’inv(8)(p23.1q22.1) dans la population hispanique aux États-Unis (Sujansky et al., 1993).,
– Chromosomes avec plus de 7 à 10 rapports résumés dans cette étude:des cas impliquant les chromosomes 4 et 5 pourraient avoir été plus fréquemment observés en raison d’études cytogénétiques plus détaillées chez des patients atteints du syndrome de Wolf-Hirschhorn (OMIM 194190) et du syndrome Cri – du-Chat (OMIM 123450), respectivement. Les Chromosomes 13, 18 et 21 sont les chromosomes humains les plus pauvres en gènes, ainsi, les délétions partielles sont plus tolérables que pour les autres autosomes., Les Chromosomes 7 et 11 sous-tendent l’impression et sont donc également liés à des troubles d’impression bien connus ; ainsi, les patients atteints de ces troubles peuvent également être étudiés plus en détail que d’autres. Les aberrations du chromosome X peuvent entraîner des problèmes de détermination du sexe et / ou d’infertilité—de telles aberrations sont donc plus susceptibles d’être ramassées que d’autres (autosomiques)., Pour les chromosomes 3 et 10 , où des recombinants sont également régulièrement observés (Figure 2), ces deux chromosomes présentent dans certaines populations des inversions péricentriques régulièrement importantes, comme celles rapportées pour le chromosome 8 dans la population hispanique aux États-Unis.
– Chromosomes rarement observés résumés dans cette étude: parmi les chromosomes restants, certains sont relativement riches en gènes (comme les chromosomes 1 et 19) ou acrocentriques (dans lesquels les inversions péricentriques sont assez rares, chrs. 13,14, 15, 21 et 22).,
outre les facteurs encore discutés influençant potentiellement les fréquences des chromosomes recombinants chez la progéniture humaine viable, différents taux de recombinaison et points chauds de recombinaison le long de chaque chromosome et en fonction de la méiose de genre sont décrits comme bien décrits par Bhatt et al. (2014) peuvent également avoir un impact ici.,
selon Gardner et Amor (2018), la formation de chromosomes recombinants dans les gamètes de porteurs d’inversion péricentriques est fonction de la taille de l’inversion: plus l’inversion est grande, plus les recombinants sont fréquemment observables dans les gamètes. En outre, P-suppression / Q-duplication-apparaissent à peu près dans les mêmes fréquences que q-suppression/P-duplication-recombinants. Cependant, comme le suggèrent déjà les données D’Ishii et al. (1997), la délétion p/duplication q est à peu près deux fois plus fréquente que la délétion q/duplication p dans les formes viables de chromosomes recombinants., Compte tenu de la différence précédemment discutée des CNV, étant présents sous forme de gains ou de pertes, il faudrait considérer en général un nombre plus faible de gènes sensibles au dosage dans le bras p des chromosomes humains que dans les bras Q.
dans l’ensemble, voici un examen à jour des recombinants viables basés sur l’inversion péricentromérique., Considérant également de nouvelles informations récentes sur l’influence des réarrangements chromosomiques sur l’architecture interphasique (mot-clé: domaines topologiques associés = TADs) (Schrank et Gautier, 2019), ainsi que sur le chevauchement des points d’arrêt conservés évolutifs (importants dans la spéciation) et des points d’arrêt observés dans les cas cliniques (Liehr et al., 2011), l’importance des aberrations cytogénétiques grossières pour fournir une meilleure compréhension des principes généraux du génome humain est mise en évidence.
déclaration de disponibilité des données
Les ensembles de données de cette étude peuvent être demandés aux auteurs.,
énoncé D’éthique
l’examen et l’approbation éthiques n’étaient pas requis pour l’étude sur les participants humains conformément à la législation locale et aux exigences institutionnelles. Les patients / participants ont fourni leur consentement éclairé écrit pour participer à cette étude.
contributions des auteurs
TL a rédigé le document et fait la recherche documentaire. AW a effectué les analyses cytogénétiques de la famille 1. KM a effectué les analyses aCGH de la famille 1. MZ, NP et AA-R ont effectué les analyses des poissons des deux familles. KW a fourni à la famille 1 des renseignements cliniques.,
conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière pouvant être interprétée comme un conflit d’intérêts potentiel.
Remerciements
Asta Cramer et Gabriele Hickmann (Essen, Allemagne) sont grandement reconnues pour avoir fourni family 2.
Matériel Supplémentaire
Daniel, A. (1981). Les différences de structure dans les inversions péricentriques. Application à un modèle de risque de recombinants. Hum. Genet. 56, 321–328. doi: 10.,1007/BF00274687
PubMed Abstract | CrossRef Texte Intégral | Google Scholar
Gardner, RJMcK, Amor, D. J. (2018).Les anomalies chromosomiques de Gardner et Sutherland et le conseil génétique. New York: Oxford, Université De La Presse.
Google Scholar
Liehr, T. (2006). Les petits chromosomes marqueurs surnuméraires familiaux sont principalement hérités par la lignée maternelle. Genet. Med. 8, 459–462. doi: 10.1097/00125817-200607000-00011
CrossRef Texte Intégral | Google Scholar




