un ligand est un ion ou une molécule qui se lie à un atome de métal central pour former un complexe (également connu sous le nom d’entité de coordination).

Ligands sont généralement considérés comme donneurs d’électrons attirés par le métal au centre du complexe. Les métaux sont des accepteurs d’électrons.
les Ligands peuvent être des espèces neutres ou chargées négativement avec des paires d’électrons disponibles. L’eau est un ligand commun., Ici, une molécule d’eau est représentée avec ses deux paires d’électrons solitaires.

Une paire d’électrons du ligand, telle que l’eau, fournit les deux électrons pour la liaison qui se forme entre elle-même et l’atome ou l’ion métallique central.
ici, un seul ligand L, qui pourrait être de l’eau, donne une paire d’électrons pour former une liaison avec un atome de métal M.
Ligands Monodentés
les ligands monodentés n’ont qu’un seul atome capable de se lier à un atome
H20 et NH3 sont des exemples de ligands neutres monodentés.,
lorsque H20 est un ligand, l’oxygène est l’atome donneur se liant au métal. Lorsque NH3 est un ligand, l’azote est l’atome donneur se liant au métal.
des exemples de ligands monodentés chargés électriquement sont les ions halogénures, tels que: F-, Cl-, Br-, I-et cyano, CN-.
La charge globale de l’ensemble est la somme arithmétique de l’état d’oxydation du métal dans le centre, plus la charge(s) a introduit le complexe par chaque ligand.
Ligands Polydentés
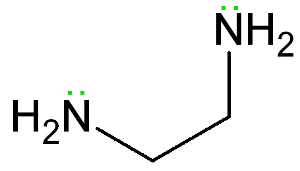 exemple d’un ligand bidenté., L’éthane-1,2-diamine a deux paires d’électrons solitaires indiquées en vert.
exemple d’un ligand bidenté., L’éthane-1,2-diamine a deux paires d’électrons solitaires indiquées en vert. une molécule de ligand avec plus d’un atome donneur est un ligand polydentate appelé. Ceux-ci reçoivent des noms spécifiques, en fonction du nombre d’atomes donneurs qu’ils contiennent.
les Ligands Bidentés
les ligands Bidentés ont deux atomes capables de se lier à un atome de métal central ou à un ion.
L’éthane-1,2-diamine (représenté sur l’image) est un exemple de ligand bidentate.
Les deux nitrogènes de cette molécule peuvent agir comme donneurs d’électrons, se liant à un atome de métal central ou à un ion.,
D’autres exemples de ligands bidentates sont l’ion acétylacétonate, connu sous le nom de (acac), et l’ion oxalate (ox).
 Exemple d’un ligand tridenté. Le 1,4,7-triazaheptane (également connu sous le nom de diéthylènetriamine) a trois paires isolées d’électrons indiquées en vert.
Exemple d’un ligand tridenté. Le 1,4,7-triazaheptane (également connu sous le nom de diéthylènetriamine) a trois paires isolées d’électrons indiquées en vert. les Ligands Tridentés et les Ligands Polydentés supérieurs
les ligands Tridentés ont trois atomes capables de se lier à un atome métallique central ou à un ion.,
Les molécules avec quatre atomes donneurs sont appelées ligands tétradentés; cinq atomes donneurs, pentadentés; et six atomes donneurs hexadentés.
Un complexe qui contient un ligand polydentate est appelé un chélate.
l’image ci-dessous de la liaison de L’EDTA à un atome de métal central est un exemple de chélate. En outre, voir composés de couronne.
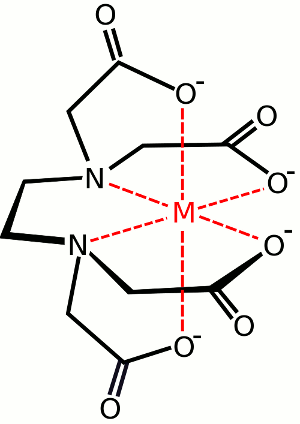 Exemple d’un hexadenté ligand. EDTA (également connu sous le nom d’acide éthylènediaminetétraacétique). L’image montre un complexe formé entre L’EDTA et une espèce métallique centrale.,Si le métal était Fe à l’état d’oxydation III, le complexe serait –
Exemple d’un hexadenté ligand. EDTA (également connu sous le nom d’acide éthylènediaminetétraacétique). L’image montre un complexe formé entre L’EDTA et une espèce métallique centrale.,Si le métal était Fe à l’état d’oxydation III, le complexe serait – Ligands Ambidentés
les ligands Ambidentés sont des ligands monodentés qui peuvent se lier à deux endroits possibles. Par exemple, l’ion nitrate NO2 – peut se lier à l’atome/ion métallique central au niveau de l’atome d’azote ou de l’un des atomes d’oxygène.L’ion thiocyanate, SCN-peut se lier au métal central au soufre ou à l’azote.




