conjugaison en chimie organique: définition, exemples, Exploration et conséquences
ceci est le premier d’une série de messages qui couvriront éventuellement la conjugaison, les systèmes pi, La théorie des orbitales moléculaires, les diènes, les additions 1,2 et 1,4, la réaction de Diels Alder et d’autres réactions péricycliques. Nous allons commencer par revoir les bases!,Révélé par sa forme de résonance « deuxième meilleure”
L’une des premières choses que vous apprenez sur les alcènes est que la rotation autour de la liaison C-C Pi (π) Ne se produit pas., Par exemple, à des températures et des pressions normales., le trans-2-butène (illustré ci-dessous à gauche) ne se convertit jamais spontanément en cis-2-butène (à droite) . Ce sont des composés séparables, avec différents points de fusion et d’ébullition. Vous pouvez acheter chacun d’eux séparément D’Aldrich. Cela ne serait pas possible s’il y avait une rotation libre sur la double liaison.,
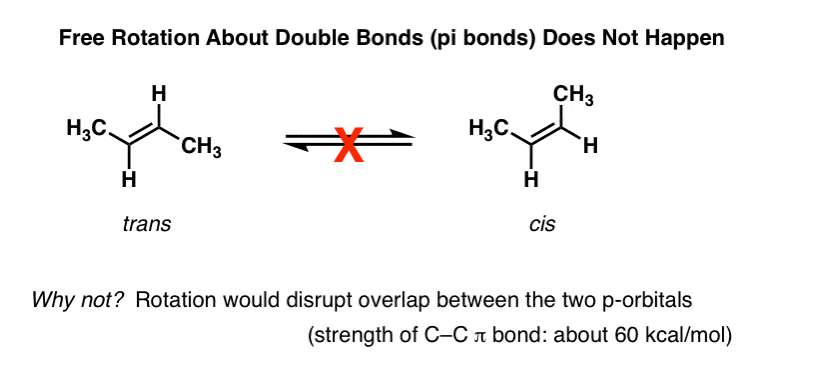
en approfondissant cela, nous avons vu que cela est dû à un phénomène appelé « liaison pi” – un chevauchement latéral de deux orbitales p adjacentes, contenant chacune un électron, ce qui se traduit par une orientation préférée où les orbitales p « s’alignent” l’une à côté de l’autre, comme des soldats. En raison de la géométrie en forme d’haltère de l’orbitale p, le chevauchement n’est pas possible lorsque les deux orbitales p sont à 90° l’une de l’autre, ce qui explique cette « barrière de rotation”.,
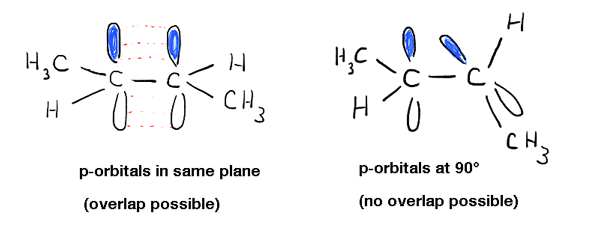
cela a d’autres conséquences physiques que la barrière de rotation: il influence également la géométrie moléculaire. Puisque la liaison Pi est un phénomène exclusif aux orbitales p, cela signifie que chaque liaison pi à laquelle participe un atome laissera une orbitale P de moins disponible pour « l’hybridation” avec l’orbitale s sur l’atome. Il en résulte la géométrie « planaire trigonale” (sp2 ) familière pour les carbones alcènes typiques et la géométrie « linéaire” (sp) pour les carbones alcynes.
Par conséquent, les alcènes sont « plats”, par opposition aux carbones alkyles, qui adoptent une géométrie tétraédrique.,
L’Importance du chevauchement Orbital pour la liaison Pi
Une illustration éclatante de l’importance du chevauchement orbital est présentée par un cas où nous pourrions naïvement penser qu’une double liaison « devrait” se former – mais ne le fait pas. Bredt a observé en 1924 que les alcènes ont tendance à ne pas se former sur des positions de « tête de pont”, comme dans la molécule en bas à gauche, une observation qui a été appelée « règle de Bredt ».
Pourquoi pas? Si vous faites le modèle, vous verrez que la géométrie de l’anneau bicyclique force ces orbitales p à être orientées à angle droit. Il n’y a pas de chevauchement entre les orbitales p., Par conséquent, il ressemble plus à un carbone avec deux radicaux adjacents qu’à une véritable liaison pi!
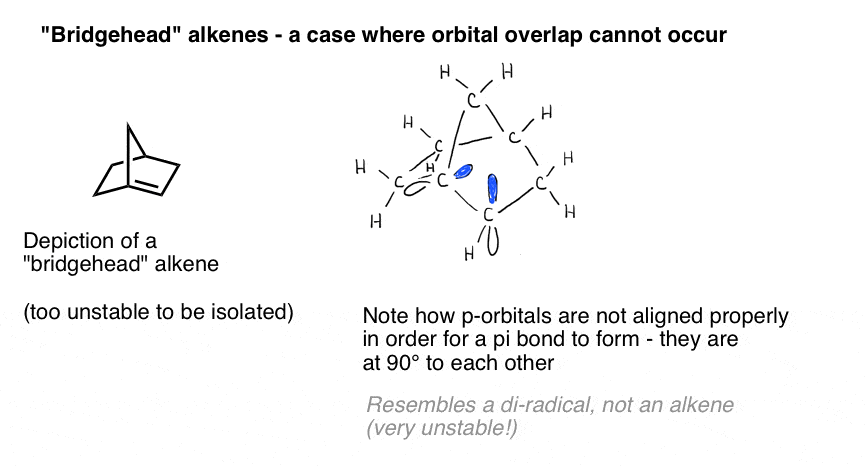
Les dessins tridimensionnels sur une surface plane ne rendent pas vraiment justice à la gloire de la structure tridimensionnelle. Voici un modèle et la vidéo qui l’accompagne.
Ces choses roses sont supposées être les p-orbitales. Vous voyez comment ils sont à angle droit l’un par rapport à l’autre? Cela signifie qu’ils ne se chevauchent pas.
via GIPHY
l’essentiel est que vous avez besoin d’un chevauchement entre les orbitales p pour qu’une liaison Pi se forme., Dans les systèmes acycliques, ce n’est généralement pas un problème
3. Au-delà des liaisons Pi: « conjugaison” de 3 orbitales p ou plus
en chimie organique du premier semestre, nous apprenons que ce chevauchement d’orbitales p n’est pas nécessairement limité à deux orbitales p adjacentes. Le chevauchement peut s’étendre au-delà de deux orbitales p pour inclure trois, quatre, cinq et même plus d’orbitales p consécutives sur des atomes consécutifs, créant des « systèmes pi” plus grands (témoin lycopène, par exemple).,
nous voyons également que la définition de « P orbitale” est quelque peu flexible, et peut inclure des exemples tels que
nous appelons cela « construire” des orbitales p en plus grands « systèmes pi”, « conjugaison”. Dans chacune des molécules du milieu ci-dessous, l’alcène (liaison pi) est conjugué avec une orbitale P adjacente.
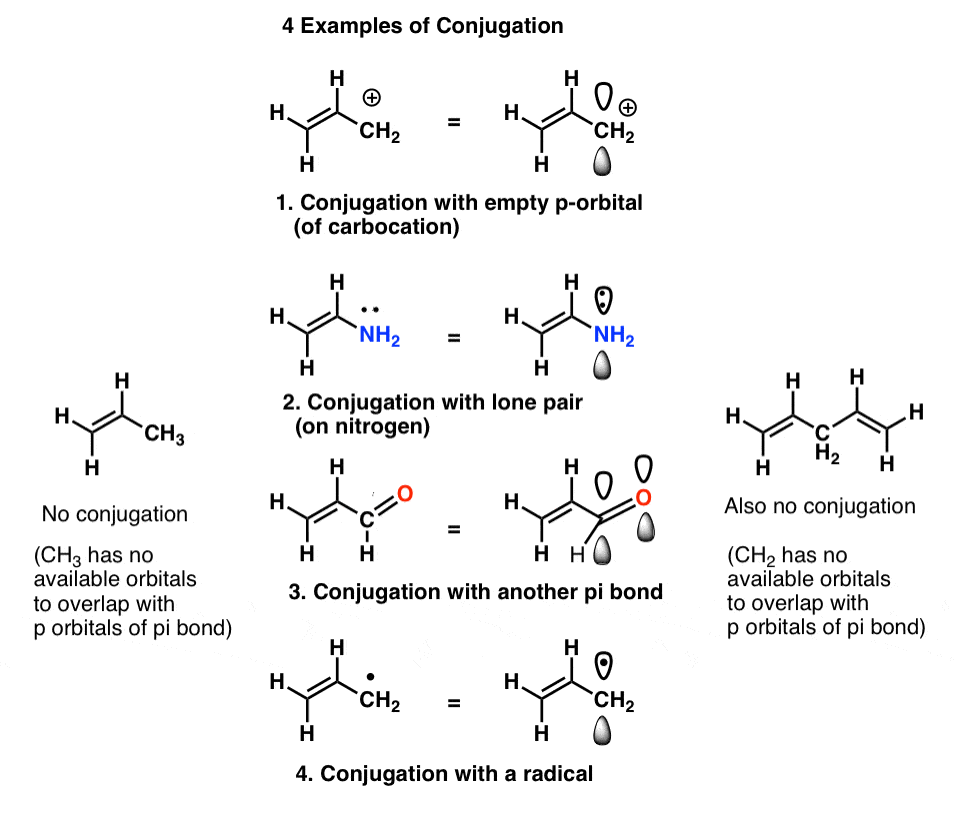
Le « Tueur de conjugaison” à surveiller est un atome dépourvu de paires isolées connectées à des liaisons simples, telles que CH2 dans l’exemple ci-dessous (1,4-pentadiène). Ces deux liaisons pi ne sont pas conjuguées.
un jeu de question piège., Sont les doubles liaisons dans la molécule ci-dessous (allène), conjugué? Pourquoi ou pourquoi pas?
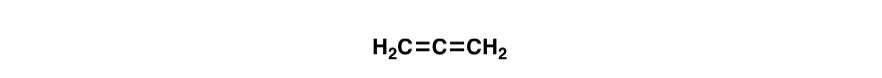
4. La Distinction entre conjugaison et résonance
vous pourriez bien demander: cela ressemble juste à la résonance. Quelle est la différence?
prenons une seconde pour distinguer la conjugaison et la résonance.
- La conjugaison est ce que nous appelons lorsque 3 orbitales p ou plus se rejoignent en un « système pi”plus grand.,
- ces systèmes Pi conjugués contiennent des électrons, que nous appelons souvent « électrons pi » pour les distinguer des électrons qui composent des liaisons simples dans la molécule.
- Les différentes dispositions des électrons dans ce « système pi” sont appelées formes de résonance.,
une analogie approximative pourrait aller comme ceci:
- pensez aux orbitales p comme étant un peu comme des « pièces” pour les électrons (occupation maximale: 2)
- joindre plusieurs pièces ensemble dans un bâtiment plus grand est une conjugaison
- Les différents arrangements admissibles des personnes (électrons) dans ce bâtiment sont des formes de résonance.
l’exigence clé pour la conjugaison est le chevauchement orbital, que nous allons développer dans un peu.
pour l’instant, passons en revue quelques conséquences de la conjugaison.,
conséquences de la conjugaison (1): longueurs de liaison
Comme je viens de le dire, nous sommes plus habitués à la conjugaison dans le contexte de la « résonance », un concept que nous avons déjà couvert (et puisque cette série entre dans le territoire du second semestre, vaut la peine de vous familiariser avec)
par exemple, avec l’ion acétate (CH3CO2)-et le cation allyle (les deux présentés ci-dessous), nous avons vu qu’il y a deux façons différentes d’organiser les électrons pi, que nous appelons « formes de résonance”.,
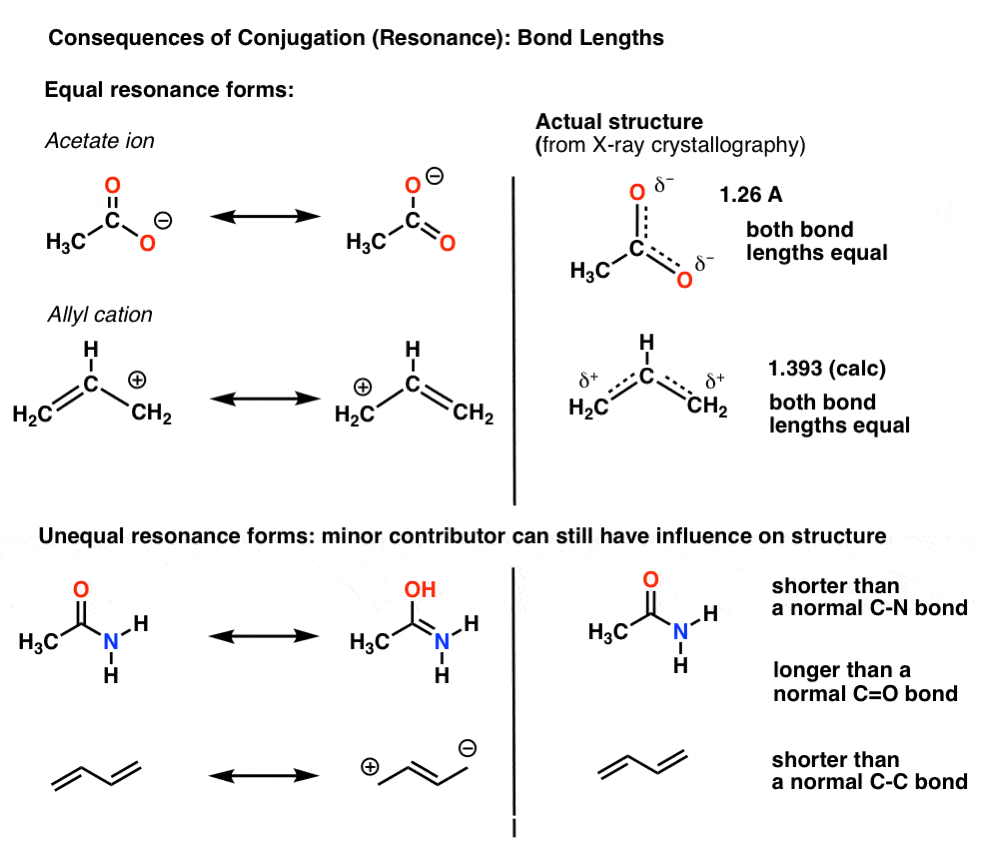
le point important à noter est que les électrons pi dans ceux-ci ne commutent pas constamment d’avant en arrière entre les atomes; plutôt, la « vraie” structure de la molécule est un hybride de ces formes de résonance.
une conséquence importante de la résonance est les longueurs de liaison qui sont intermédiaires entre deux formes.,
lorsque les formes de résonance ne sont pas identiques, L’hybride de résonance sera un hybride « pondéré” des formes de résonance les plus importantes
dans L’ion acétate et le cation allyle les deux formes de résonance importantes sont équivalentes, de sorte que les deux finissent par contribuer également à l’hybride.
une situation plus courante se trouve des molécules comme celles ci-dessous, il y a un mélange de formes de résonance inégales. Certaines formes de résonance sont plus importantes que d’autres. .,
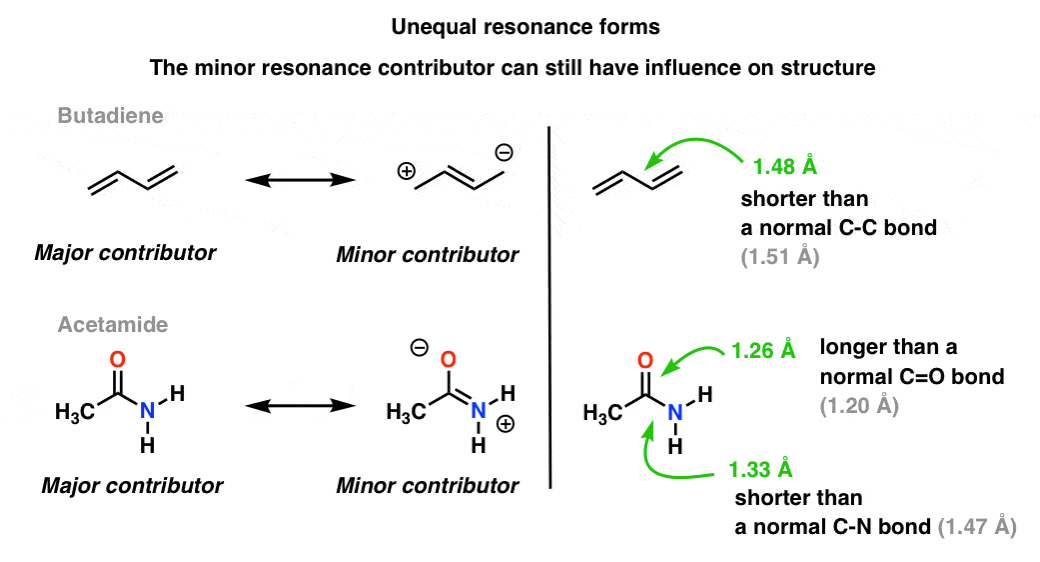
notre langage visuel de la chimie avec sa distinction nette entre les liaisons simples et doubles ne représente pas avec précision la densité électronique dans les molécules, qui sont un hybride pondéré de formes de résonance. Les contributeurs mineurs de résonance influencent les longueurs de liaison dans la molécule, les rendant plus courtes ou plus longues que la normale.
dans la molécule supérieure (butadiène), cette liaison C-C centrale est un peu plus courte qu’une liaison simple C-C « est-à-dire qu’elle a un peu de caractère de liaison double) en raison de l’influence de la résonance mineure contributrice à l’hybride.,
dans la molécule inférieure (« acétamide”), la liaison C-O est un peu plus longue qu’une liaison C=O « normale” (c.-à-d. a plus de caractère à liaison simple) et la liaison C-N est un peu plus courte qu’une liaison C-N « normale” (c.-à-d. a plus de caractère à double liaison). Cela reflète l’influence du « contributeur mineur” (ou du « deuxième Meilleur” contributeur, si vous le souhaitez) dans lequel il existe une liaison C-n pi et une liaison C-O unique.
faisons notre premier saut conceptuel.
7., Conséquences de la conjugaison (2): doubles liaisons « partielles”
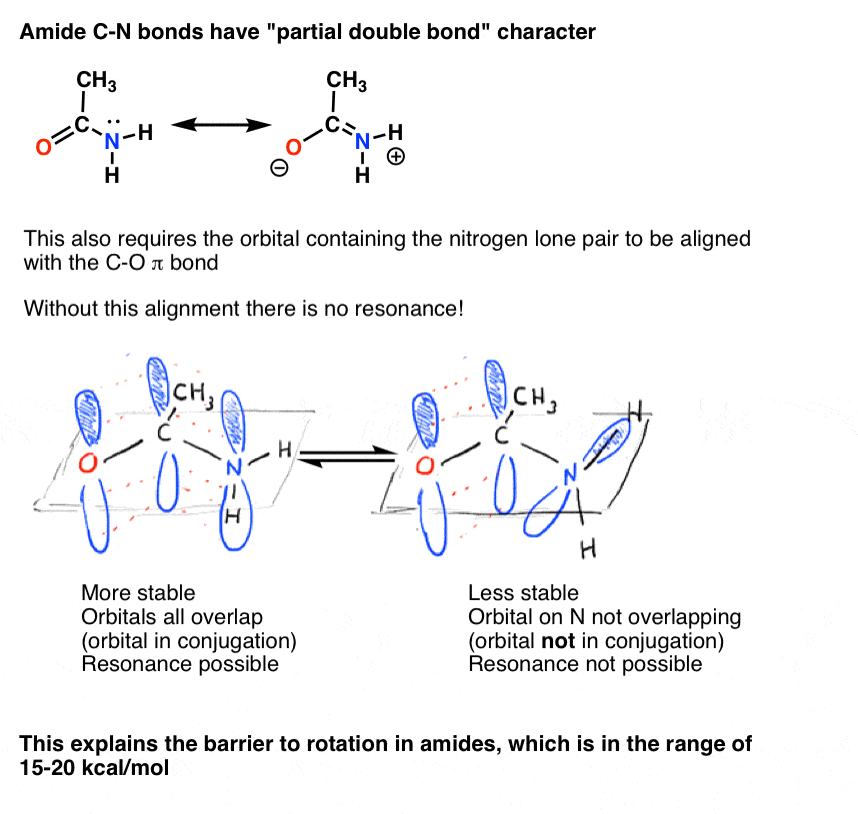
Il y a une conséquence intéressante de ce « caractère de double liaison partielle” dans la liaison C-N. Il a une » barrière à la rotation « tout comme nous nous attendrions d’un”double lien »! La barrière à la rotation dans la liaison C-N des amides est d’environ 15-20 kcal / mol dans les liaisons peptidiques (comparer à environ 2-3 kcal/mol pour la plupart des liaisons C-C).
cela signifie que les deux conformations peuvent encore s’interconvertir, mais elles le font relativement lentement à température ambiante., Dans la molécule ci-dessous (N-méthyl acétamide), il est possible d’observer séparément le conformère s-cis (les deux groupes méthyle verts du même côté de la liaison C-N) et le conformère s-trans (groupes méthyle verts des côtés opposés de la liaison C-N). Cela n’est généralement pas possible pour les conformateurs à moins que vous ne preniez la température à 100 Kelvin environ!
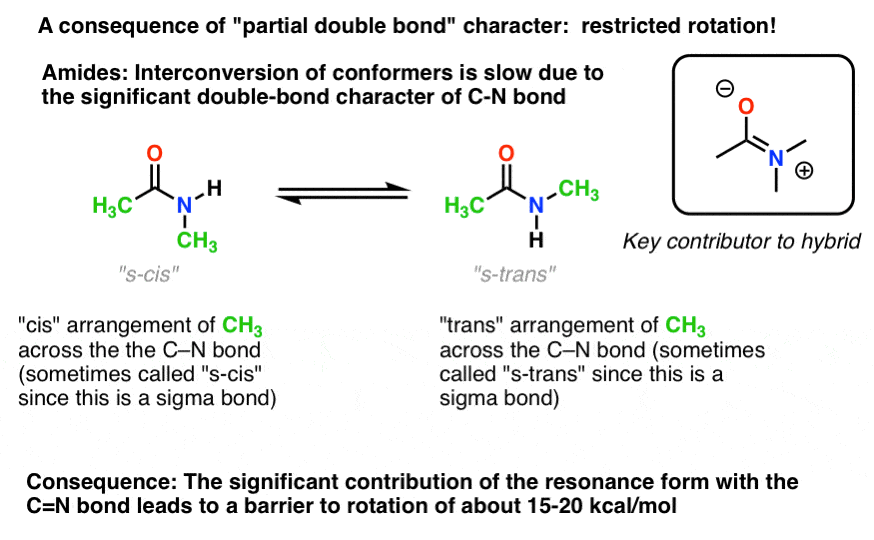
Pour l’image ci-dessus, le concept crucial ici est seulement partielle de la double liaison de caractère. Si s-cis et s-trans n’ont pas de sens pour vous après y avoir réfléchi un peu, c’est OK., Pas crucial pour le reste de la discussion.
conséquences de la conjugaison (3): la réactivité d’un système conjugué est souvent révélée par sa forme de résonance « seconde meilleure”
Nous Avons montré l’effet que la conjugaison (et par extension, la résonance) a sur les longueurs de liaison.
examinons de plus près son effet sur la densité électronique, qui influence finalement la réactivité.
à titre d’illustration, continuons à regarder les alcènes.
la réactivité d’un alcène peut être modifiée de façon spectaculaire par la fixation de divers groupes.,
regardez la « deuxième meilleure” forme de résonance lorsque nous attachons un donneur de pi tel que N(CH3)2 à un alcène. Il en résulte une accumulation de charge négative (δ -) sur le carbone terminal de l’alcène, avec pour résultat que cet alcène (que nous appelons une énamine) est un excellent nucléophile. Pour ne prendre qu’un exemple important, les émaux réagissent avec des halogénures d’alkyle (tels que CH3I) et d’autres électrophiles dans une classe de réactions parfois appelées réactions D’Énamine de cigogne après leur découvreur, Gilbert Stork. Les alcènes ordinaires tels que le 2-butène (ci-dessous) ne fonctionnent pas dans cette réaction.,
la fixation d’un PI-accepteur tel que C=O entraîne une accumulation de charge positive (δ+) sur le carbone terminal de l’alcène, de sorte que cette espèce (que nous appelons un aldéhyde insaturé α, β, accepteur de Michael ou énone) est un excellent électrophile. les carbonyles α, β insaturés réagissent avec les nucléophiles (tels que CH3S–) et de nombreuses autres classes de nucléophiles dans un type général de réaction que nous appelons additions conjuguées ou parfois réactions de Michael.,
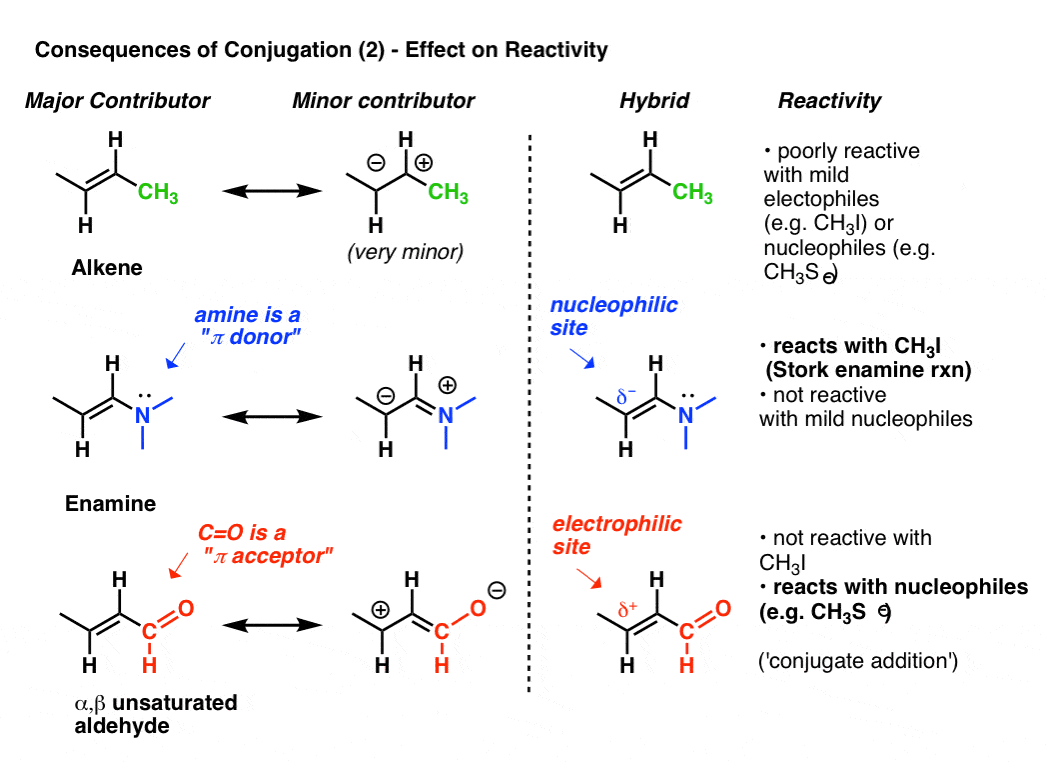
C’est juste la pointe de l’iceberg, car de la façon dont la conjugaison peut affecter la réactivité, mais c’est assez pour aujourd’hui.
9., Le chevauchement Orbital (toutes les orbitales p dans le même plan) est nécessaire pour la conjugaison (et la résonance)
Jusqu’à présent, nous avons vu que:
- le chevauchement entre les orbitales p est nécessaire pour former des liaisons pi
- certaines « liaisons simples” peuvent avoir un « caractère de liaison pi” en raison de la contribution> pour que la conjugaison existe, et donc pour que la résonance se produise, toutes les orbitales p doivent se chevaucher. Ils doivent donc tous être alignés dans le même plan.,
rappelez-vous le « cation allyle” qui est « stabilisé par résonance”? Pour que le carbocation obtienne cette « stabilisation par résonance », l’orbitale p vide sur le carbocation doit être alignée avec la liaison Pi adjacente.
Si l’orbitale p est à un angle de 90 degrés des orbitales p dans la liaison pi, il n’y a pas de conjugaison et donc pas de stabilisation par résonance.
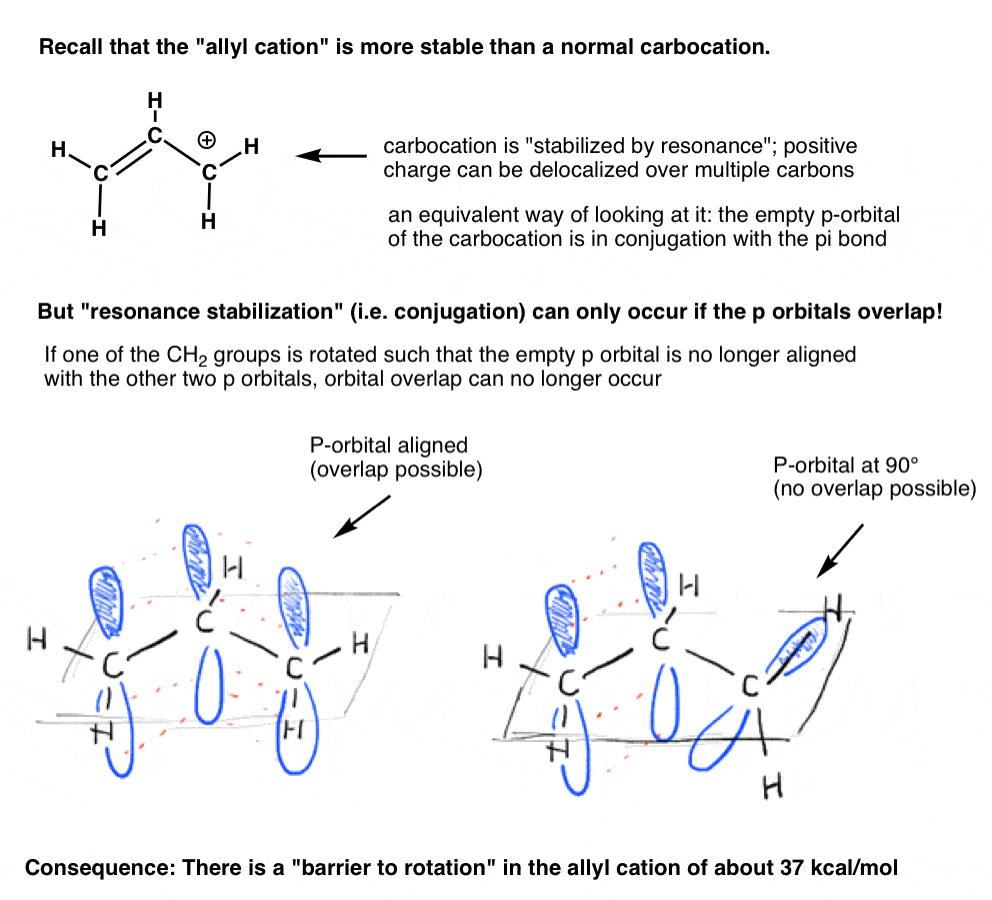
Comme on pourrait le prédire, il y a une barrière à la rotation dans le cation allyle, tout comme il est un obstacle à la rotation dans un alcène., La barrière à la rotation dans le cation allyle est d’environ 37 kcal / mol – un peu plus de la moitié de la force d’une liaison C-C pi.
nous avons également vu que la liaison C-N dans les amides a un caractère de double liaison partielle, avec une barrière à la rotation d’environ 15-20 kcal/mol.
de même, ce caractère de « double liaison partielle” n’est possible que si l’orbitale P contenant la paire Solitaire est capable de se chevaucher avec les orbitales p comprenant la liaison C=O pi.,
le caractère de double liaison partielle de la liaison C-N dans les amides a longtemps été considéré comme la principale raison pour laquelle ils sont beaucoup plus résistants à la rupture que, disons, les esters . Puisque les protéines dans notre corps sont jointes par des liens de peptide (amide), c’est une question d’importance non négligeable! Les formes de vie basées sur les liaisons ester plutôt que amide seraient beaucoup plus fragiles!,
les Amides de tête de Pont ne sont pas conjuguées et sont beaucoup plus facilement brisées que les Amides « ordinaires”
les amides de tête de Pont donnent une illustration de ce qui arrive aux amides lorsque le chevauchement est impossible.
tout comme nous l’avons vu dans les alcènes de tête de pont, dans les amides de tête de pont, le chevauchement orbital entre la paire Solitaire d’azote et le carbone carbonyle est impossible en raison de la torsion. Le résultat est que la liaison C-N n’a pas de caractère de double liaison partielle et qu’elle est beaucoup plus facile à rompre qu’un amide « normal”.
l’amide de tête de pont ci-dessous est « quinuclidone”, un amide tordu qui a échappé à la synthèse pendant des décennies., Ce n’est qu’en 2006 qu’il a finalement été fabriqué (comme son acide conjugué) par une voie astucieuse par le laboratoire de Brian Stoltz à Caltech.
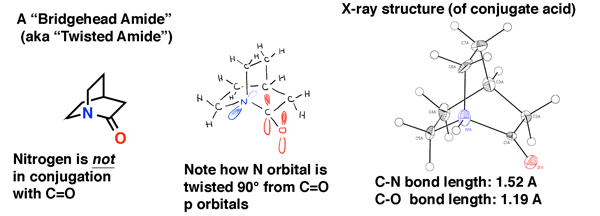
La structure cristalline aux rayons X, témoigne de l’absence de conjugaison dans ce amide. La longueur de la liaison C-N est de 1,52 Å (typique d’une seule liaison C-N) et la longueur de la liaison C=O est de 1,19 Å, ce qui est typique d’une longueur de liaison dans un aldéhyde ou une cétone (1,20 Å). On s’attendrait donc à ce qu’il soit un peu plus instable vers l’attaque nucléophile qu’un amide normal, ce qui a été confirmé dans l’étude du laboratoire Stoltz.,
plus de conséquences de la conjugaison: couleur et Cycloadditions
Jusqu’à présent, cet article a été à peu près une revue des concepts du 1er semestre. Il n’y a rien dans la discussion ci-dessus qui ne puisse être raisonnablement expliqué par ce que nous avons déjà appris sur la conjugaison et la résonance.
Cependant, cette approche simpliste ne peut prendre jusqu’à présent.
deux exemples rapides, car ce post a duré assez longtemps.,
Tout d’abord: conjugaison et couleur
Si vous avez vu ce post sur le fonctionnement de l’eau de Javel, vous avez appris que lorsque nous allongeons la longueur de conjugaison, nous changeons la longueur d’onde à laquelle les molécules absorbent la lumière. Certaines molécules très colorées telles que le carotène, la chlorophylle et le lycopène ont toutes de très longues doubles liaisons conjuguées.
Par exemple, le lycopène est responsable de la couleur rouge des tomates. Si nous enlevons les doubles liaisons, nous enlevons la couleur. Pourquoi?
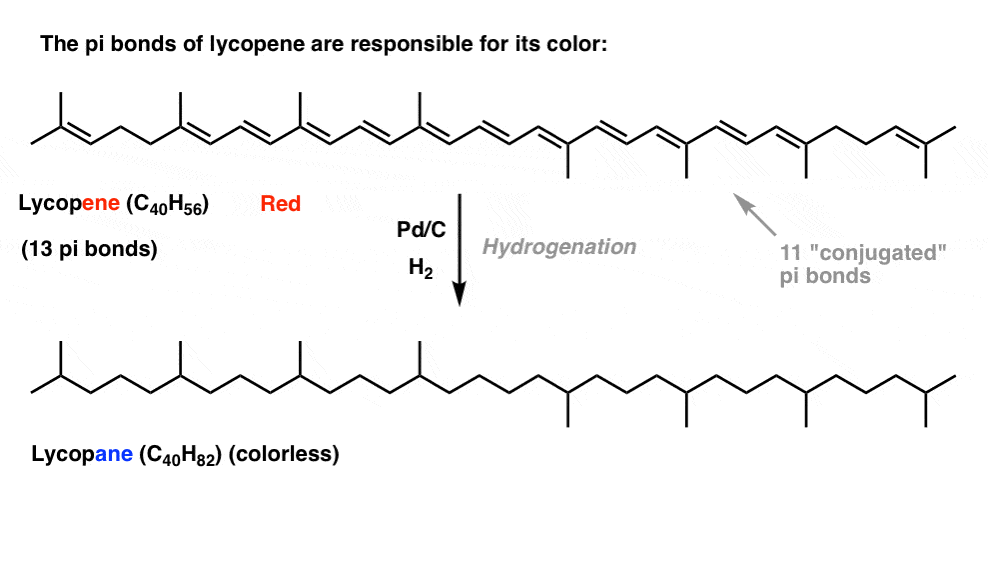
Quelle est la relation entre la couleur et la conjugaison?, Pourquoi le nombre de doubles liaisons aurait-il une influence sur cela? Résonance ne parvient pas à éclairer ce sujet.
Deuxièmement: réactions des diènes qui forment des anneaux
Voici quelques réactions étranges pour vous.
Si vous traitez le butadiène avec la molécule à sa droite (maléate de méthyle), vous obtenez un nouveau produit contenant un cycle à six chaînons. Rien de ce que nous avons vu jusqu’à présent ne nous prépare à ce type de réaction, qui s’appelle une « cycloaddition”.
fait intéressant, si vous traitez l’éthène avec la même molécule, rien ne se passe (sauf si vous le traitez avec la lumière UV., Ensuite, vous obtenez une bague à 4 membres, mais je m’égare).
pourquoi?
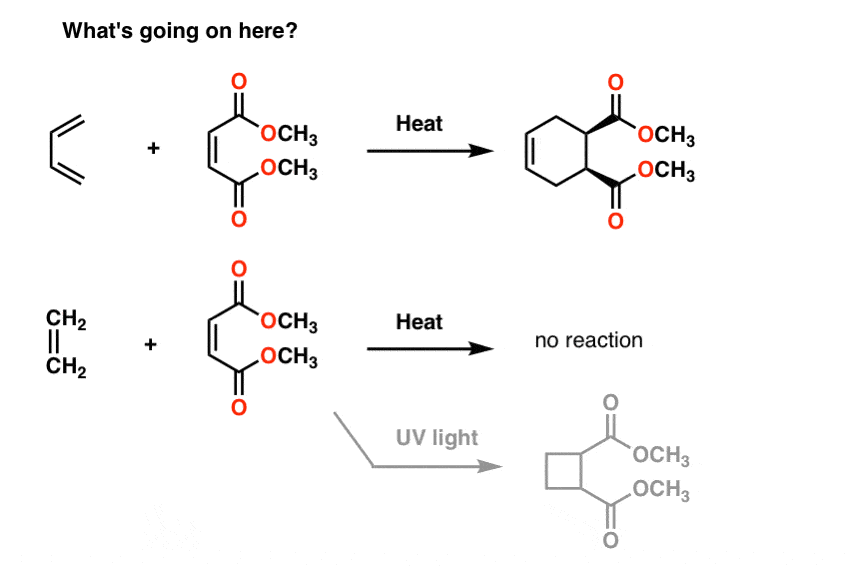
la Résonance ne nous aide pas ici non plus.
suivant: théorie de l’orbitale moléculaire
ce qui nous aidera à répondre à ces questions, ainsi qu’à bien d’autres à l’avenir, c’est un concept appelé théorie de l’orbitale moléculaire.
dans les articles suivants de cette série, nous allons approfondir la façon dont les orbitales p se chevauchent pour former des orbitales moléculaires, et nous examinerons les niveaux d’énergie de ces orbitales., Nous verrons également comment cela influence la réactivité des molécules et nous permet de faire des prédictions sur leur comportement chimique.
Comme nous le verrons, la théorie des orbitales moléculaires nous fournit un ensemble très puissant de concepts qui nous aideront à comprendre la réactivité chimique à un niveau beaucoup plus profond.
Merci à Tom Struble pour toute son aide avec ce post.
Notes
la souche A-1,2 est la raison pour laquelle le tétra-tert-butyléthylène n’a pas encore été synthétisé.
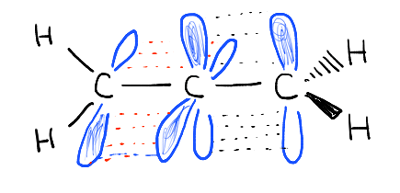
Les liaisons pi ne sont pas conjuguées. Regardez les orbitales comprenant les deux liaisons pi., Ils sont perpendiculaires les uns aux autres et ne peuvent pas se chevaucher.
en Utilisant la RMN, spectroscopie de résonance magnétique nucléaire. Ces isomères conformationnels sont parfois appelés « isomères rotationnels” ou « rotamères » et ils peuvent compliquer considérablement les spectres RMN. Les pics peuvent généralement être fusionnés en chauffant la sonde d’échantillon.
cela contraste avec, disons, différentes formes de chaise de cyclohexane, qui peuvent généralement encore interconvertir à température ambiante et fusionner en un seul pic., Cependant, si vous refroidissez suffisamment un cyclohexane substitué, vous pouvez « congeler » les différents conformères et les observer séparément.




