un ligando es un ion o molécula que se une a un átomo metálico central para formar un complejo (alternativamente conocido como entidad de coordinación).

los ligandos son generalmente considerados como donantes de electrones atraídos por el metal en el centro del complejo. Los metales son aceptores de electrones.
los ligandos pueden ser especies neutras o cargadas negativamente con pares de electrones disponibles. El agua es un ligando común., Aquí se muestra una molécula de agua con sus dos pares solitarios de electrones.

un par de electrones del ligando, como el agua, proporciona ambos electrones para el enlace que se forma entre él y el átomo o ion metálico central.
aquí un solo ligando L, que podría ser agua, dona un par de electrones para formar un enlace con un átomo metálico M.
ligandos Monodentados
los ligandos Monodentados tienen solo un átomo capaz de unirse a un átomo o ion metálico central.
H20 y NH3 son ejemplos de ligandos monodentados neutros.,
cuando H20 es un ligando, el oxígeno es el átomo donante que se une al metal. Cuando el NH3 es un ligando, el nitrógeno es el átomo donante que se une al metal.
ejemplos de ligandos monodentados cargados eléctricamente son los iones haluro, tales como: F-, Cl-, Br-, I-, y cyano, CN-.
la carga total en un complejo es la suma aritmética del Estado de oxidación del metal en el centro más la carga(S) traída al complejo por cada ligando.
Polydentate Ligandos
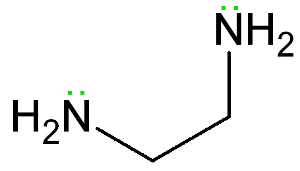 Ejemplo de un ligando bidentado., El etano-1,2-diamina tiene dos pares solitarios de electrones mostrados en verde.
Ejemplo de un ligando bidentado., El etano-1,2-diamina tiene dos pares solitarios de electrones mostrados en verde. una molécula de ligando con más de un átomo donante se denomina ligando polidentado. A estos se les dan nombres específicos, dependiendo de cuántos átomos donantes contengan.
ligandos bidentados
los ligandos bidentados tienen dos átomos capaces de unirse a un átomo o ion metálico central.
etano-1,2-diamina (mostrado en la imagen) es un ejemplo de un ligando bidentado.
ambos nitrógenos en esta molécula pueden actuar como donantes de electrones, uniéndose a un átomo metálico central o ion.,
otros ejemplos de ligandos bidentados son el ion acetilacetonato, conocido como (acac), y el ion oxalato (ox).
 Ejemplo de un ligando tridentado. 1,4,7-triazaheptano (también conocido como dietilentriamina) tiene tres pares solitarios de electrones mostrados en verde.
Ejemplo de un ligando tridentado. 1,4,7-triazaheptano (también conocido como dietilentriamina) tiene tres pares solitarios de electrones mostrados en verde.los ligandos Tridentados y los ligandos Polidentados superiores
los ligandos Tridentados tienen tres átomos capaces de unirse a un átomo o ion metálico central.,
Las moléculas con cuatro átomos donantes se llaman ligandos tetradentados; cinco átomos donantes, pentadentado; y seis átomos donantes hexadentados.
un complejo que contiene un ligando polidentado se llama Quelato.
la imagen que se muestra a continuación de la Unión de EDTA a un átomo metálico central es un ejemplo de un quelato. También, ver crown compounds.
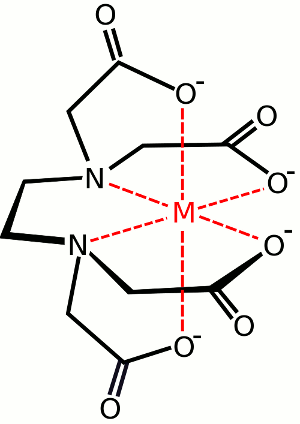 Ejemplo de un hexadentate ligando. EDTA (también conocido como ácido etilendiaminotetraacético). La imagen muestra un complejo formado entre EDTA y una especie metálica central.,Si el metal fuera Fe en estado de oxidación III, el complejo sería –
Ejemplo de un hexadentate ligando. EDTA (también conocido como ácido etilendiaminotetraacético). La imagen muestra un complejo formado entre EDTA y una especie metálica central.,Si el metal fuera Fe en estado de oxidación III, el complejo sería – ligandos Ambidentados
los ligandos Ambidentados son ligandos monodentados que se pueden unir en dos lugares posibles. Por ejemplo, el ion nitrato NO2 – puede unirse al átomo/ion metálico central en el átomo de nitrógeno o en uno de los átomos de oxígeno.El ion tiocianato, SCN-puede unirse al metal central en el azufre o el nitrógeno.




