conjugación en Química Orgánica: definición, ejemplos, exploración y consecuencias
Este es el primero de una serie de posts que eventualmente cubrirán conjugación, sistemas pi, teoría de orbitales moleculares, dienos, adiciones 1,2 y 1,4, la reacción de aliso de Diels y otras reacciones pericíclicas. Vamos a empezar por revisar los conceptos básicos!,Revelado por su forma de resonancia «segunda mejor»
revisitando el Pi enlace (y enlace Pi): superposición Orbital «lateral» entre orbitales p adyacentes
una de las primeras cosas que aprendes sobre los alquenos es que la rotación sobre el enlace Pi (π) de c-c no ocurre., Por ejemplo, a temperaturas y presiones normales., trans-2-buteno (mostrado abajo a la izquierda) nunca se observa que se convierta espontáneamente a CIS-2-buteno (derecha) . Son compuestos separables, con diferentes puntos de fusión y ebullición. Usted puede comprar cada uno de ellos por separado de Aldrich. Esto no sería posible si hubiera rotación libre sobre el doble enlace.,
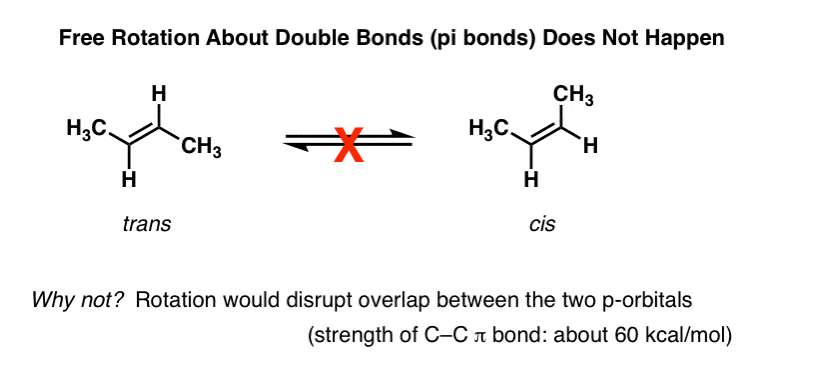
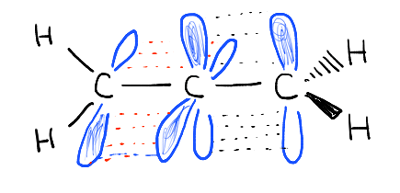
profundizando en esto, hemos visto que esto se debe a un fenómeno llamado «enlace pi» – una superposición lateral de dos orbitales p adyacentes, cada uno conteniendo un electrón, lo que resulta en una orientación preferida donde los orbitales p «se alinean» uno al lado del otro, como soldados. Debido a la geometría tipo mancuerna del orbital p, la superposición no es posible cuando los dos orbitales p están a 90° entre sí, lo que explica esa «barrera rotacional».,
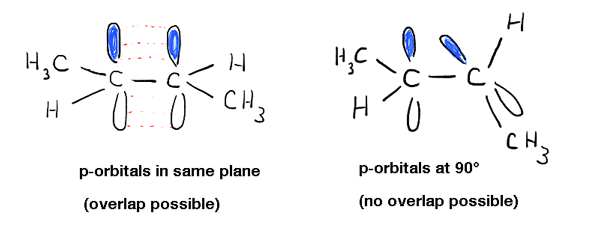
esto tiene otras consecuencias físicas además de la barrera de rotación: también influye en la geometría molecular. Dado que el enlace Pi es un fenómeno exclusivo de los orbitales p, eso significa que cada enlace pi en el que participa un átomo dejará un orbital p menos disponible para la «hibridación» con el orbital s en el átomo. Esto resulta en la geometría familiar «trigonal planar» (sp2) para carbonos alquenos típicos y geometría «lineal» (sp) para carbonos alquinos.
Por lo tanto, los alquenos son «planos», a diferencia de los carbonos alquilos, que adoptan una geometría tetraédrica.,
la importancia de la superposición Orbital para la Unión Pi
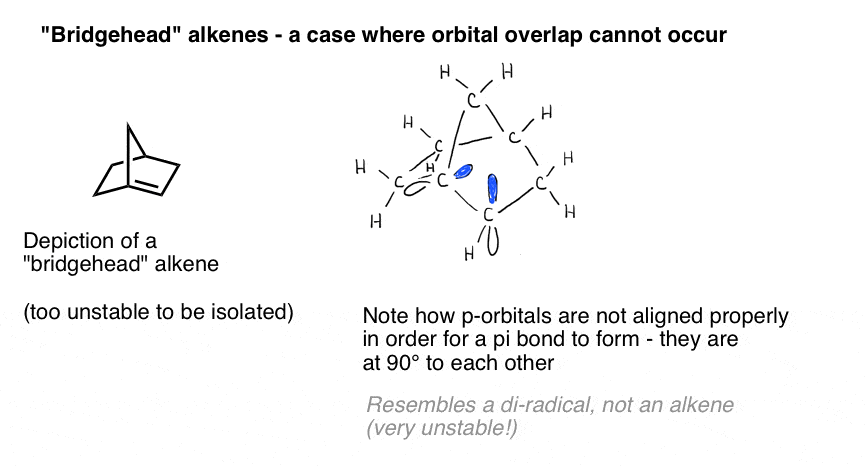
una ilustración vívida de la importancia de la superposición orbital se presenta por un caso en el que podríamos pensar ingenuamente que un doble enlace «debería» formarse, pero no lo hace. Bredt observó en 1924 que los alquenos tienden a no formarse en posiciones de «cabeza de puente», como en la molécula en la parte inferior izquierda, Una observación que llegó a ser llamada»regla de Bredt».
¿por Qué no? Si haces el modelo, verás que la geometría del anillo bicíclico obliga a esos orbitales p a orientarse en ángulos rectos. No hay superposición entre los orbitales P., Por lo tanto, se asemeja más a un carbono con dos radicales adyacentes que a un enlace Pi real.
los dibujos tridimensionales sobre una superficie plana realmente no hacen justicia a la gloria de la estructura tridimensional. Aquí hay un modelo y un video que lo acompaña.
esas cosas rosadas se supone que son los p-orbitales. ¿Ves cómo están en ángulo recto el uno con el otro? Eso significa que no se superponen.
a través de GIPHY
la conclusión es que necesita superposición entre orbitales p para que se forme un enlace Pi., En sistemas acíclicos eso generalmente no es un problema
3. Más allá de los enlaces Pi: «conjugación» de 3 o más orbitales p
en química orgánica del primer semestre aprendemos que esta superposición de orbitales p no se limita necesariamente a dos orbitales p adyacentes. La superposición puede extenderse más allá de dos orbitales p para incluir tres, cuatro, cinco e incluso más orbitales p consecutivos en átomos consecutivos, construyendo «sistemas pi» más grandes (licopeno testigo, por ejemplo).,
también vemos que la definición de «orbital p» es algo flexible, y puede incluir ejemplos como
a esto lo llamamos «construcción» de orbitales p en «sistemas pi» más grandes, «conjugación». En cada una de las moléculas medias a continuación, el alqueno (enlace pi) se conjuga con un orbital P adyacente.
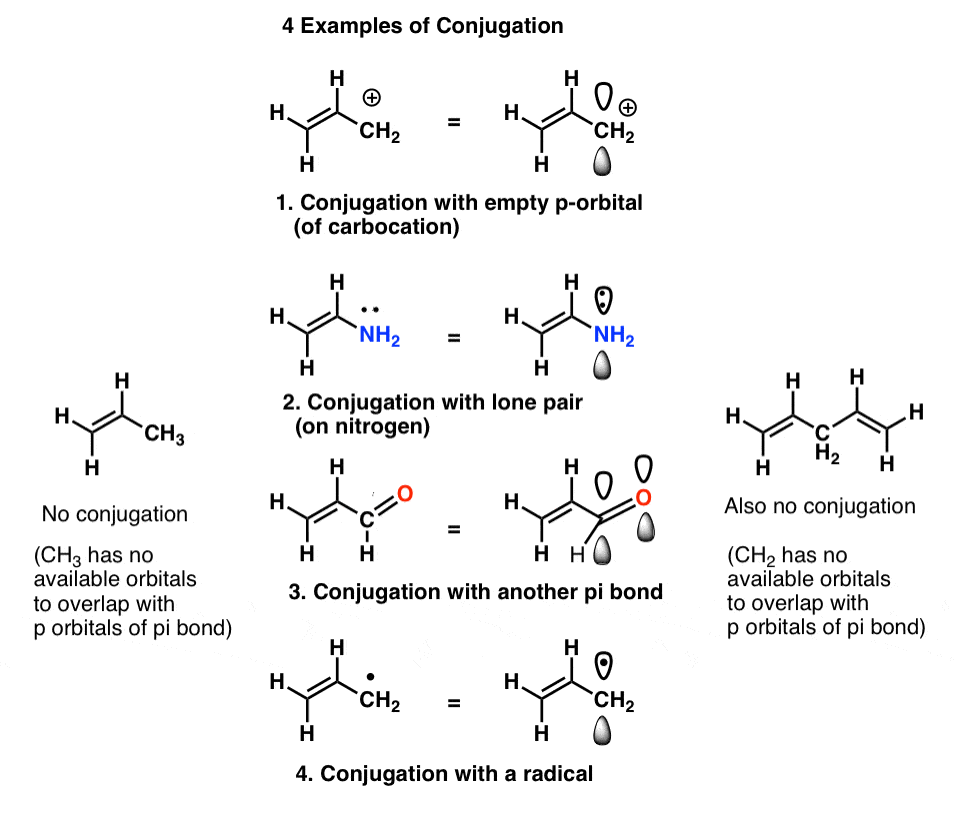
El «asesino de conjugaciones» a tener en cuenta es un átomo que carece de pares solitarios conectados a enlaces simples, como CH2 en el ejemplo de abajo a la derecha (1,4-pentadieno). Estos dos enlaces pi no están conjugados.
Aquí hay una pregunta trampa divertida., ¿Están conjugados los enlaces dobles en la molécula de abajo (aleno)? Por qué o por qué no?
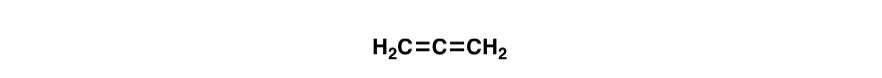
4. La distinción entre conjugación y resonancia
bien podría preguntarse: esto solo suena como resonancia. ¿Cuál es la diferencia?
tomemos un segundo para distinguir la conjugación y la resonancia.
- La conjugación es lo que llamamos cuando 3 o más orbitales p se unen en un «sistema pi» más grande.,
- estos sistemas Pi conjugados contienen electrones, que a menudo llamamos «electrones pi» para distinguirlos de los electrones que comprenden enlaces simples en la molécula.
- Los diferentes arreglos de electrones dentro de ese «sistema pi» se llaman formas de resonancia.,
una analogía aproximada podría ser así:
- piense en los orbitales p como si fueran un poco como «habitaciones» para electrones (ocupación máxima: 2)
- unir varias habitaciones juntas en un edificio más grande es conjugación
- Las diferentes disposiciones permitidas de personas (electrones) dentro de ese edificio son formas de resonancia.
el requisito clave para la conjugación es la superposición orbital, que vamos a ampliar en un poco.
Por ahora, repasemos algunas consecuencias de la conjugación.,
consecuencias de la conjugación (1): longitudes de enlace
como acabo de decir, estamos más acostumbrados a la conjugación en el contexto de «resonancia», un concepto que hemos cubierto antes (y ya que esta serie está entrando en territorio del segundo semestre, vale la pena volver a familiarizarse con)
por ejemplo, con el ion acetato (CH3CO2)-y el catión alilo (ambos se muestran a continuación), vimos que hay dos formas diferentes de organizar los electrones pi, que llamamos «Resonance forms».,
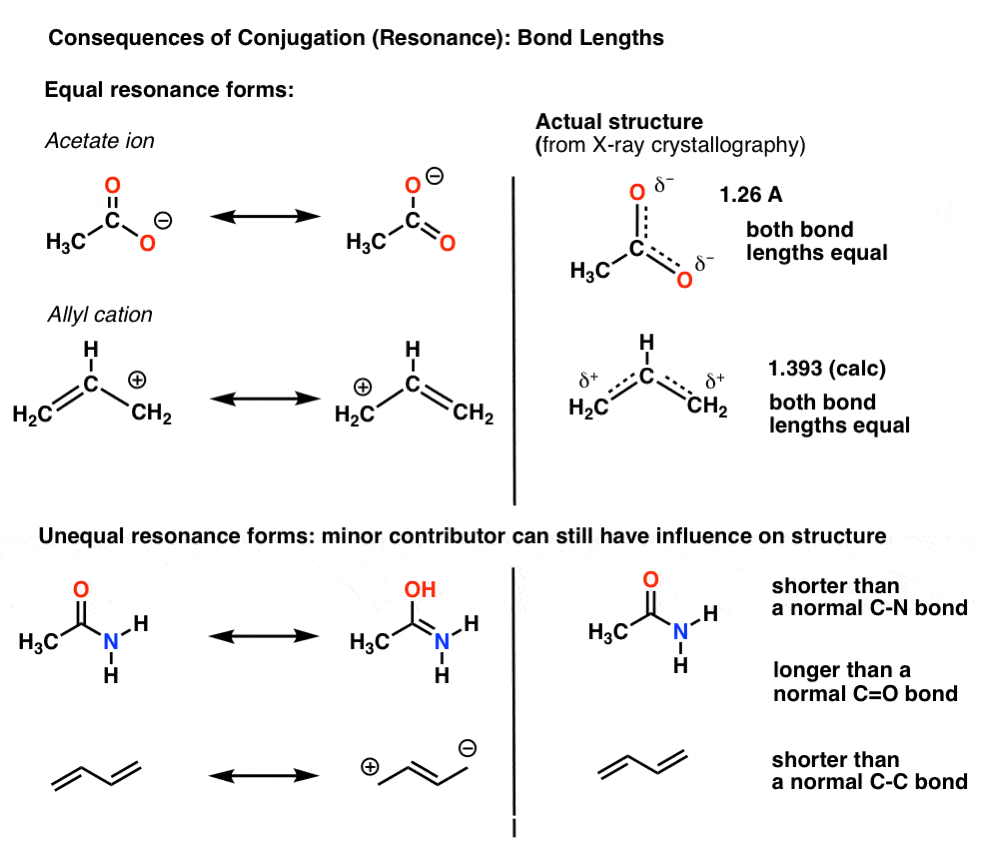
el punto importante a tener en cuenta es que los electrones pi en estos no están cambiando constantemente entre átomos; más bien, la estructura «verdadera» de la molécula es un híbrido de estas formas de resonancia.
una consecuencia importante de la resonancia son las longitudes de enlace que son intermedias entre dos formas.,
cuando las formas de resonancia no son idénticas, el híbrido de resonancia será un híbrido «ponderado» de las formas de resonancia más importantes
en el ion acetato y el catión alilo las dos formas de resonancia importantes son equivalentes, por lo que ambas terminan contribuyendo igualmente al híbrido.
una situación más común es encontrar moléculas como las de abajo hay una mezcla de formas de resonancia desiguales. Algunas formas de resonancia son más importantes que otras. .,
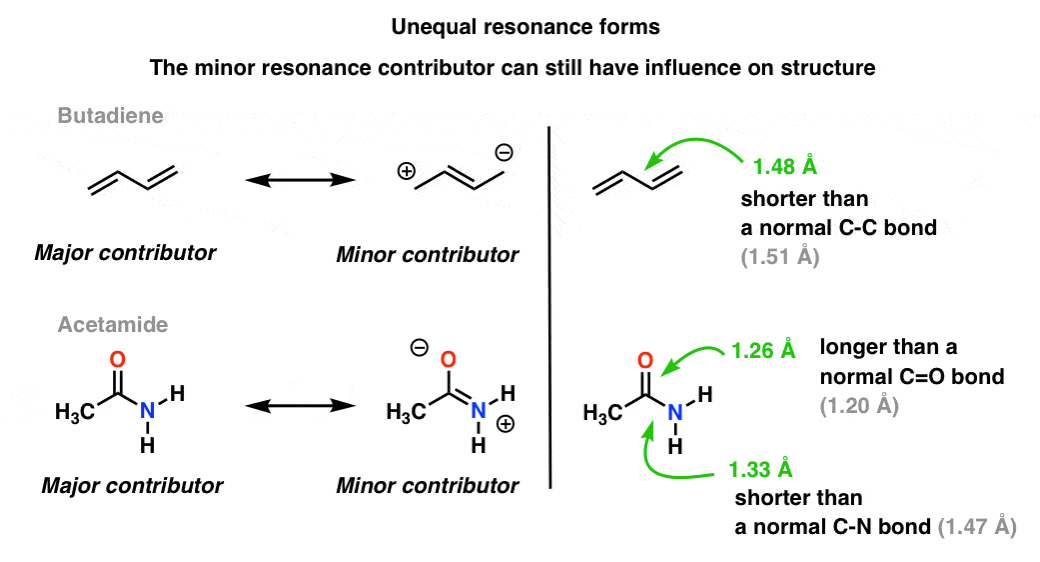
nuestro lenguaje visual de la química con su aguda distinción entre enlaces simples y dobles no representa con precisión la densidad electrónica en las moléculas, que son un híbrido ponderado de formas de resonancia. Los contribuyentes de resonancia menores influyen en las longitudes de enlace en la molécula, haciéndolas más cortas o más largas de lo normal.
en la molécula superior (butadieno), ese enlace C-C central es un poco más corto que un enlace simple C-C «normal» (es decir, tiene un poco de carácter de enlace doble) debido a la influencia del contribuyente de resonancia menor al híbrido.,
en la molécula inferior («acetamida») el enlace C-O es un poco más largo que un enlace C=o» normal «(es decir, tiene más carácter de enlace simple) y el enlace C-N es un poco más corto que un enlace C-N» normal » (es decir, tiene más carácter de enlace doble). Esto refleja la influencia del» contribuyente menor «(o» segundo mejor » contribuyente, si lo desea) en el que hay un enlace C-N pi y un enlace C-o simple.
hagamos nuestro primer salto conceptual.
7., Consecuencias de la conjugación (2): enlaces dobles «parciales»
Hay una consecuencia interesante de ese «carácter de enlace doble parcial» en el enlace C-N. ¡Tiene una » barrera a la rotación «como esperaríamos de un»doble enlace»! La barrera a la rotación en el enlace C-N de las amidas es de aproximadamente 15-20 kcal / mol en los enlaces peptídicos (compare con aproximadamente 2-3 kcal/mol para la mayoría de los enlaces C-C).
lo que esto significa es que las dos conformaciones todavía pueden interconvertirse, pero lo hacen relativamente lentamente a temperatura ambiente., En la molécula de abajo (N-metil acetamida) es posible observar el conformador s-cis (ambos grupos metilo verdes en el mismo lado del enlace C-N) y el conformador s-trans (grupos metilo verdes en lados opuestos del enlace C-N) por separado. Esto por lo general no es posible para los conformadores a menos que tome la temperatura a 100 Kelvin o así!
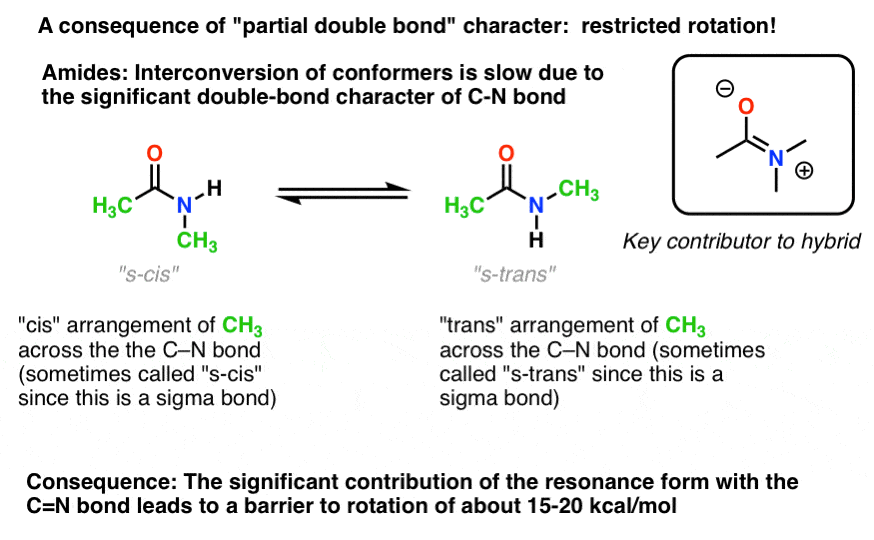
para la imagen de arriba, el concepto crucial aquí es solo el carácter de doble enlace parcial. Si s-cis y s-trans no tienen sentido para ti después de pensarlo un poco, está bien., No es crucial para el resto de la discusión.
consecuencias de la conjugación (3): la reactividad de un sistema conjugado a menudo se revela por su «segunda mejor» forma de resonancia
hemos mostrado el efecto que la conjugación (y por extensión, la resonancia) tiene en las longitudes de enlace.
echemos un vistazo más de cerca a su efecto sobre la densidad electrónica, que en última instancia influye en la reactividad.
para fines ilustrativos, continuemos mirando los alquenos.
la reactividad de un alqueno puede modificarse dramáticamente a través de la Unión de varios grupos.,
mire la forma de resonancia» segunda mejor » cuando adjuntamos un donante pi como N (CH3) 2 a un alqueno. Esto resulta en una acumulación de carga negativa (δ -) en el carbono terminal del alqueno, con el resultado de que este alqueno (que llamamos enamina) es un excelente nucleófilo. Para tomar solo un ejemplo prominente, las esmaltinas reaccionan con haluros de alquilo (como CH3I) y otros electrofilos en una clase de reacciones a veces referidas como reacciones de Enamina de cigüeña por su descubridor, Gilbert Stork. Los alquenos ordinarios como el 2-buteno (abajo) no funcionan en esta reacción.,
La Unión de un aceptor de pi como C = o resulta en una acumulación de carga positiva (δ+) en el carbono terminal del alqueno, con el resultado de que esta especie (que llamamos un aldehído insaturado α, β, aceptor Michael, O enona) es un electrofilo excelente. los carbonilos no saturados α, β reaccionan con nucleófilos (como CH3S -) y muchas otras clases de nucleófilos en un tipo general de reacción que llamamos adiciones conjugadas o a veces reacciones de Michael.,
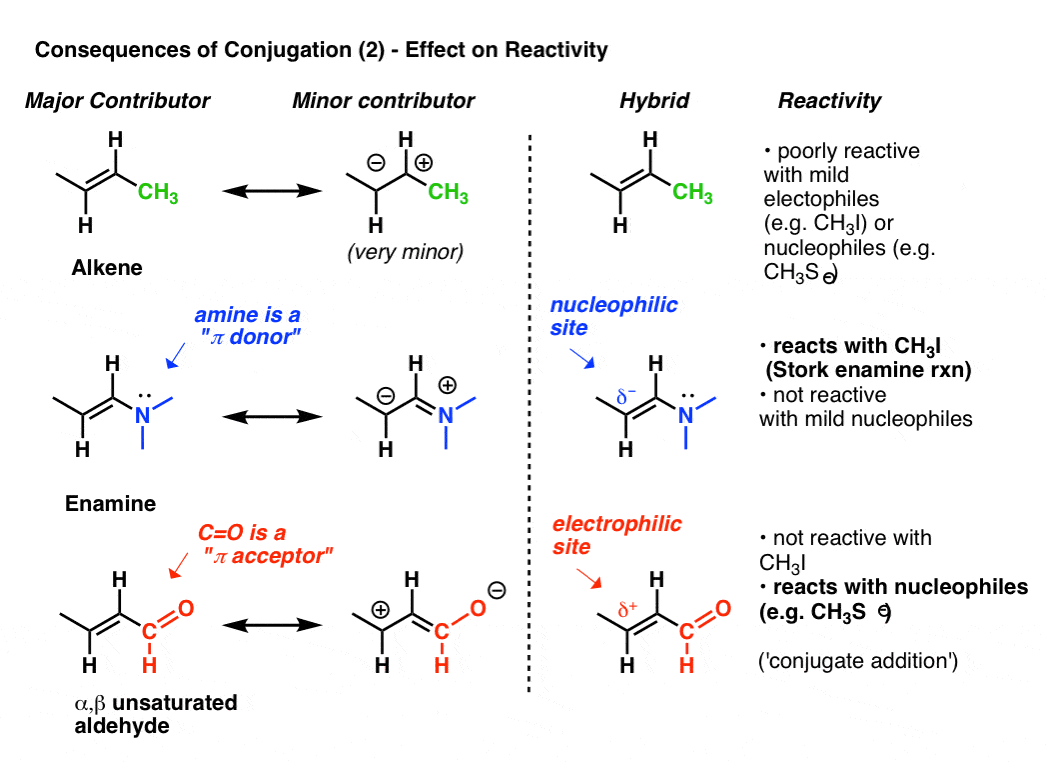
esto es solo la punta del iceberg en cuanto a cómo la conjugación puede afectar la reactividad, pero es suficiente por hoy.
9., La superposición Orbital (todos los orbitales p en el mismo plano) es necesaria para la conjugación (y resonancia)
hasta ahora hemos visto que:
- La superposición entre orbitales p es necesaria para formar enlaces pi
- Algunos «enlaces simples» pueden tener «carácter de enlace pi» debido a la contribución de una forma de resonancia menor (como amidas, por ejemplo)
Aquí está la consecuencia lógica de estas dos declaraciones:
- para que exista la conjugación, y por lo tanto para que ocurra la resonancia, todos los orbitales p deben superponerse. Por lo tanto, todos deben estar alineados en el mismo plano.,
¿recuerdas el «catión alílico» que está «estabilizado por resonancia»? Para que el carbocatión obtenga esta «estabilización de resonancia», el orbital P vacío en el carbocatión debe alinearse con el enlace pi adyacente.
si el orbital p está en un ángulo de 90 grados desde los orbitales p en el enlace pi, no hay conjugación y, por lo tanto, no hay estabilización de resonancia.
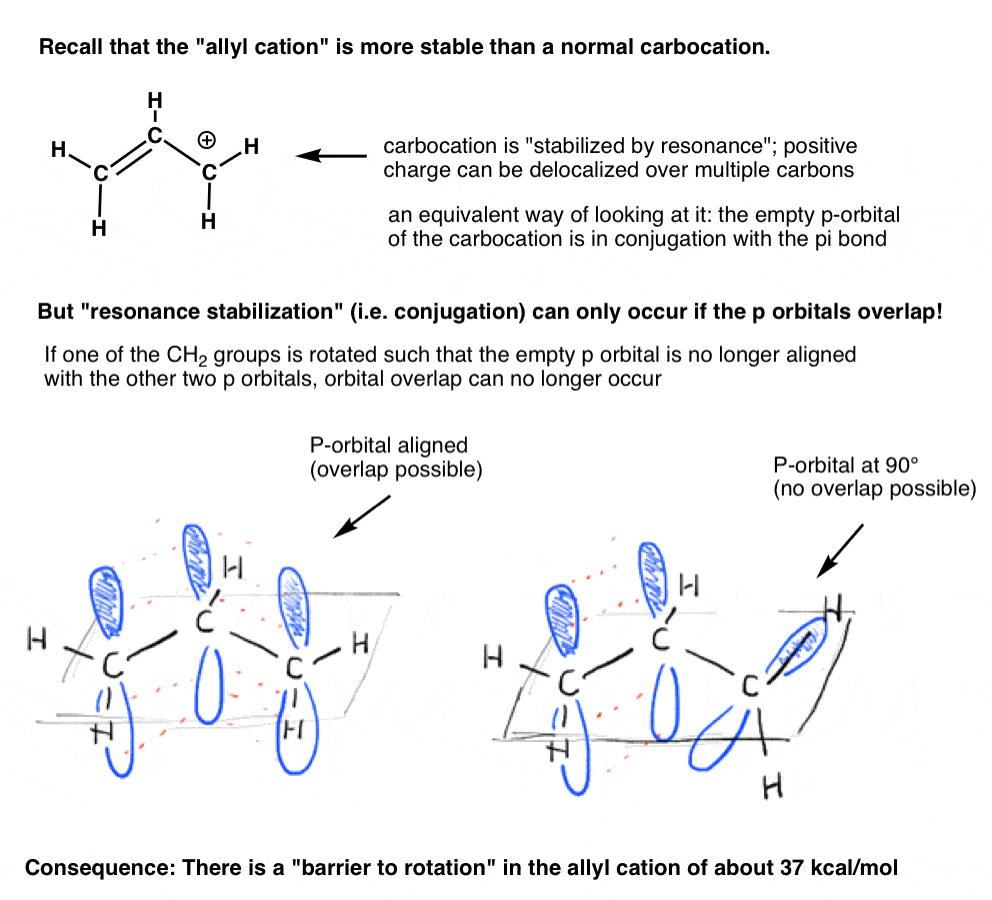
Como podemos predecir, hay una barrera a la rotación en el catión alílico, al igual que hay una barrera a la rotación en un alqueno., La barrera a la rotación en el catión alílico es de aproximadamente 37 kcal/mol, un poco más de la mitad de la fuerza de un enlace pi C – c.
También vimos que el enlace C-N en amidas tiene carácter de doble enlace parcial, con una barrera a la rotación de aproximadamente 15-20 kcal / mol.
del mismo modo, este carácter de «doble enlace parcial» solo es posible si el orbital p que contiene el par solitario es capaz de superponerse con los orbitales p que comprenden el enlace C=o pi.,
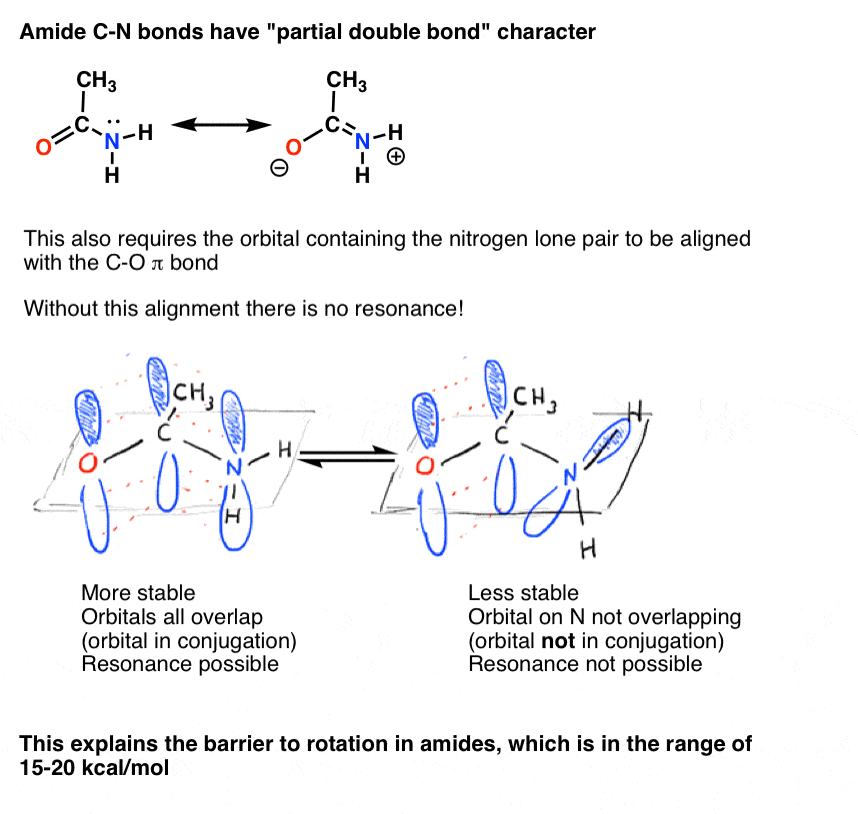
el carácter de doble enlace parcial del enlace C-N en las amidas se ha pensado durante mucho tiempo que es la razón principal por la que son mucho más resistentes a la rotura que, por ejemplo, los ésteres . Dado que las proteínas en nuestro cuerpo están unidas por enlaces peptídicos (amida), ¡esto es un asunto de no poca importancia! Las formas de vida basadas en éster en lugar de enlaces amida sería mucho más frágil!,
las amidas de cabeza de puente no se conjugan, y se rompen mucho más fácilmente que las amidas «ordinarias»
las amidas de cabeza de Puente dan una ilustración de lo que sucede con las amidas cuando la superposición es imposible.
tal como vimos en alquenos de cabeza de puente, en amidas de cabeza de Puente, la superposición orbital entre el par solitario de nitrógeno y el carbono carbonilo es imposible debido a la torsión. El resultado es que el enlace C-N no tiene carácter de doble enlace parcial y es mucho más fácil de romper que una amida «normal».
la amida cabeza de Puente de abajo es «quinuclidona», una amida retorcida que eludió la síntesis durante décadas., Fue solo en 2006 que finalmente se hizo (como su ácido conjugado) a través de una ruta inteligente por el laboratorio de Brian Stoltz en Caltech.
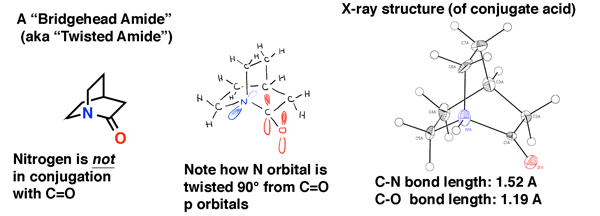
La estructura cristalina de rayos X da testimonio de la falta de conjugación en esta amida. La longitud del enlace C-N es 1.52 Å (típico de un solo enlace C-N) y la longitud del enlace C=O es 1.19 Å, que es típico de una longitud de enlace en un aldehído o cetona (1.20 Å). Por lo tanto, esperaríamos que sea un poco más inestable hacia el ataque nucleofílico que una amida normal, lo que se confirmó en el estudio del laboratorio de Stoltz.,
más consecuencias de la conjugación: color y Cicloadiciones
hasta ahora, este post ha sido una revisión de los conceptos del 1er Semestre. No hay nada en la discusión anterior que no pueda explicarse razonablemente por lo que ya hemos aprendido sobre la conjugación y la resonancia.
sin embargo, este enfoque simplista solo puede llevarnos hasta cierto punto.
dos ejemplos rápidos, porque este post ha durado lo suficiente.,
primero: conjugación y Color
si viste este post sobre cómo funciona el blanqueador, aprendiste que a medida que alargamos la longitud de la conjugación, cambiamos la longitud de onda en la que las moléculas absorben la luz. Algunas moléculas de colores muy brillantes como el caroteno, la clorofila y el licopeno tienen enlaces dobles conjugados muy largos.
por ejemplo, el licopeno es responsable del color rojo de los tomates. Si quitamos los dobles enlaces, quitamos el color. ¿Por qué?
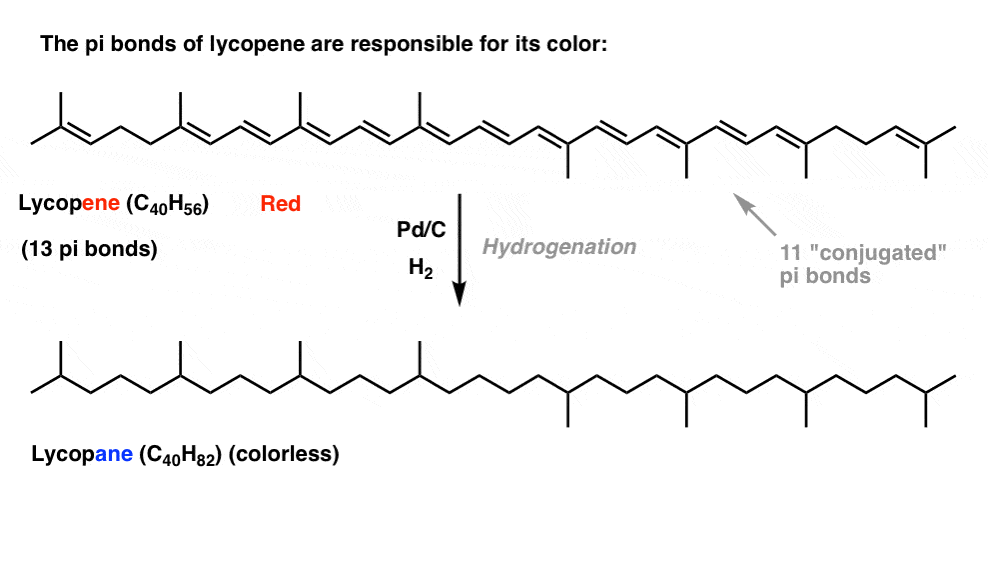
¿Cuál es la relación entre el color y la conjugación?, ¿Por qué el número de dobles enlaces tendría una influencia en esto? La resonancia no logra iluminar este tema.
segundo: reacciones de dienos que forman anillos
Aquí hay algunas reacciones extrañas para ti.
Si se trata el butadieno con la molécula a su derecha (maleato de metilo) se obtiene un nuevo producto que contiene un anillo de seis miembros. Nada de lo que hemos visto hasta ahora nos prepara para este tipo de reacción, que se llama «cicloadición».
curiosamente, si tratas el eteno con la misma molécula, no pasa nada (excepto si lo tratas con luz UV., Entonces usted consigue un anillo de 4 miembros, pero estoy divagando).
¿Por qué?
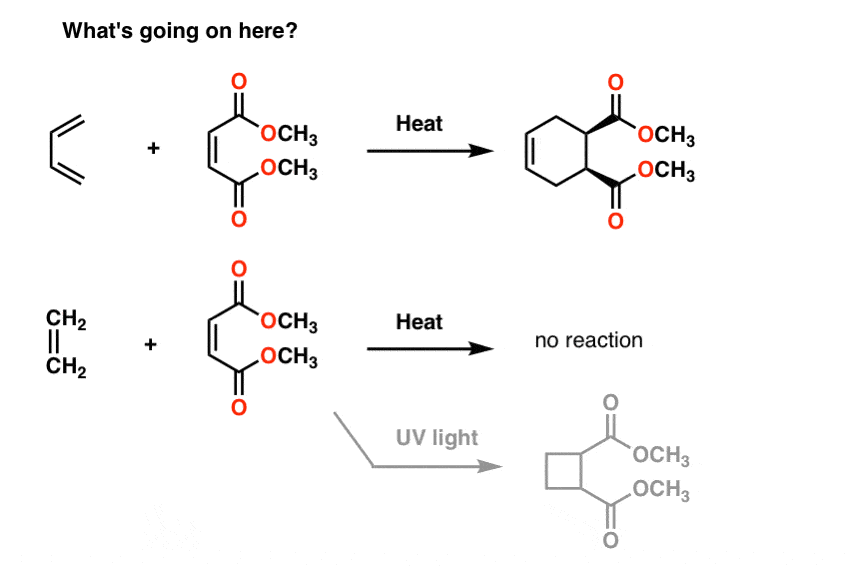
la Resonancia no nos ayuda por aquí.
siguiente: teoría de orbitales moleculares
lo que nos ayudará a responder a estas preguntas, así como a muchas otras en el futuro, es un concepto llamado teoría de orbitales moleculares.
en las siguientes publicaciones de esta serie, vamos a profundizar más en cómo los orbitales p se superponen para formar orbitales moleculares, y examinaremos los niveles de energía de estos orbitales., También veremos cómo esto influye en la reactividad de las moléculas y nos permite hacer predicciones sobre su comportamiento químico.
como veremos, la teoría de orbitales moleculares nos proporciona un conjunto muy poderoso de conceptos que nos ayudarán a entender la reactividad química a un nivel mucho más profundo.
Gracias a Tom Struble por toda su ayuda con este post.
notas
la cepa A-1,2 es la razón por la que el Tetra-terc-butiletileno aún no se ha sintetizado.
los enlaces pi no están conjugados. Mira los orbitales que comprenden los dos enlaces pi., Están en ángulo recto entre sí y no pueden superponerse.
utilizando RMN, espectroscopia de resonancia magnética nuclear. Estos isómeros conformacionales a veces se llaman «isómeros rotacionales» o «rotámeros» y pueden complicar considerablemente los espectros de RMN. Los picos generalmente se pueden hacer que se unan calentando la sonda de muestra.
esto contrasta con, por ejemplo, diferentes formas de silla de ciclohexano, que generalmente todavía pueden interconvertirse a temperatura ambiente y fusionarse en un solo pico., Sin embargo, si enfrías un ciclohexano sustituido lo suficiente, puedes «congelar» los diferentes conformadores y observarlos por separado.




